Тепловой баланс
Приход теплоты
где:
где: сг и с(Н2О) – средние теплоемкости при 360° сухого газа и водяного пара соответственно, кДж/(м3·К);
Пусть для обогрева печи необходимо сжечь х м3 природного газа, тогда:
Qсг=ΔНсг · х,
где: ΔНсг – теплота сгорания 1 м3 природного газа, определяемая исходя из теплот сгорания компонентов газа (табл.3) и его состава, кДж/м3.
Таблица 3 Теплоты сгорания углеводородов ΔНсг (У) при 18°С и 1·105 Па (кДж/кмоль):
ΔНсг= 889500 · 0,978/22,4 + 1558 · 0,005/22,4 + 2297800·0,002/22,4+ + 2870000·0,001/22,4 = 39540 кДж
Qсг=39540·х, кДж. Теплота, вносимая сжигаемым газом при 18°С:
где: сг – средняя теплоемкость газа при 18°С, кДж/(м3·К)
Общий приход тепла (кроме тепла, вносимого в печь воздухом, количество которого будет рассчитано ниже), кДж:
Расход теплоты
где:
Qр определяем в соответствии с законом Гесса для реакций (а)- (д): Qр = ΣΔНf(пр) – ΣΔНf(исх),
где: ΔНf(пр) и ΔНf(исх) – энтальпии образования продуктов реакции и исходных веществ соответственно, кДж/м3.
Qp=ΔНf(СН4) · Vк(СН4) + ΔНf(СО) · Vк(СО) + ΔНf(СО2) · Vк(СО2) + + ΔНf(Н2О) · Vк(Н2О) - ΔНf(СН4) · V(СН4) - ΔНf(С2Н6) · V(С2Н6) – - ΔНf(С3Н8) · V(С3Н8) - ΔНf(С4Н10) · V(С4Н10) - ΔНf(Н2О) · V(Н2О) = -3300 · 32,9 – 4930 · 33,8 – 7600 · 33,1 – 10800 · 150 + 3300 · 97,8 + 3680 · 0,5 + 4520 · 0,2 + 5480 · 0,1 + 10800 · 250 = 535000 кДж
Теплота влажного конвертированного газа при 700°С:
где: Vк – объем влажного конвертированного газа, м3; ск – его средняя теплоемкость, при температуре tк, кДж/(м3·К).
Для определения
СН4 + 2О2 = СО2 + 2Н2О (е) С2Н6 + 3,5О2 = 2СО2 + 3Н2О (ж) С3Н8 + 5О2 = 3СО2 + 4Н2О (з) С4Н10 + 6,5О2 = 4СО2 + 5Н2О (и) Для сжигания 1 м3 газа необходим следующий объем кислорода: V(O2) = α(V(CН4)·2 +V(C2Н6)·3,5 + V(C3Н8) · 5 +V(C4Н10) · 6,5) = 1,25(0,978 ·2 + 0,005 ·3,5 + 0,002 ·5 + 0,001 ·6,5) = 2,49 м3; Это соответствует 21% (об). в составе воздуха, следовательно, необходимое количество воздуха составит:
V(возд) = V(О2) · 100/21 = 2,49 · 100/21 = 11,8 м3. Содержание азота в воздухе: V(N2) = 11,8 – 2,49 = 9,31 м3. Количество водяного пара, поступающего с воздухом при 18°С и влажности воздуха φ=0,016 м3/м3:
Vвозд(Н2О) = V(возд) · φ = 11,8 · 0,016 = 0,19 м3.
Определим состав дымовых газов при сгорании 1 м3 газа: образуется в соответствии с уравнениями (е)-(и): –СО2: Vдым(СО2)=0,978·1+0,005·2+0,002·3+0,001·4=0,998 м3 –Н2О: Vобр(Н2О)=0,978·2+0,005·3+0,002·4+0,001·5=1,984 м3.
Останется кислорода: Vдым(О2) = 2,49 – 2,49/1,25 = 0,5 м3. Газ содержит водяных паров (с учетом влажности воздуха): Vдым(Н2О) = Vобр(Н2О) + Vвозд(Н2О) = 1,984 + 0,19 = 2,174 м3.
Состав дымового газа занесем в таблицу 4: Таблица 4 Состав дымового газа (при сжигании 1 м3 газа)
Расход теплоты с дымовым газом составит:
Приход теплоты с поступающим в печь воздухом (при 18°C):
= (11,8 · 0,983 + 0,19 · 1,79) ·18 · х = 218х, кДж
Уравнение теплового баланса трубчатой печи с учетом теплопотерь в окружающую среду (4% от прихода):
0,96(22300 + 39577х + 218х) = 535000 + 524000 + 154500х; Откуда х =37,3 м3. После подстановки значения х находим, кДж:
Расход влажного воздуха, подаваемого в топку:
Vвл(возд) = (V(возд) + Vвозд(Н2О)) · х = (11,8 + 0,19) · 37,3 = 447 м3.
Количество дымового газа:
Vдым = 13 · х = 13 · 37,3 = 485 м3.
Занесем результаты расчета теплового баланса в таблицу 5.
Тепловой баланс трубчатой печи
Варианты для самостоятельного расчета Составить материальный и тепловой балансы трубчатой печи для конверсии природного газа.
Соотношение между СО и СО2 в конвертированном газе соответствует равновесию реакции СО + Н2О = СО2 + Н2 при температуре газа на выходе из печи Расчет выполнить на 100 м3 природного газа.
|

 ,
, – физическая теплота паро-газовой смеси, кДж;
– физическая теплота паро-газовой смеси, кДж;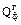 – физическая теплота сжигаемого газа, (расходуемого на обогрев трубчатой печи), кДж;
– физическая теплота сжигаемого газа, (расходуемого на обогрев трубчатой печи), кДж; – физическая теплота, вносимая воздухом, поступающим в печь, кДж;
– физическая теплота, вносимая воздухом, поступающим в печь, кДж;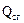 – теплота сгорания природного газа, кДж.
– теплота сгорания природного газа, кДж.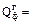 х · сг · tн,
х · сг · tн,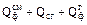 =223000 + 39540·х +37,4·х = 223000 + 39577,4·х.
=223000 + 39540·х +37,4·х = 223000 + 39577,4·х. ,
,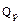 – теплота, расходуемая на проведение эндотермических реакций конверсии, кДж;
– теплота, расходуемая на проведение эндотермических реакций конверсии, кДж;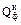 – теплота конвертированного газа, кДж;
– теплота конвертированного газа, кДж; – теплота дымовых газов, кДж;
– теплота дымовых газов, кДж; – потери теплоты в окружающее пространство, кДж.
– потери теплоты в окружающее пространство, кДж.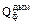 найдем количество дымовых газов, образующихся при сжигании 1 м3 природного газа до СО2 и Н2О при коэффициенте избытке воздуха α=1,25. Необходимое количество кислорода для сжигания 1 м3 газа и состав дымовых газов определим по реакциям:
найдем количество дымовых газов, образующихся при сжигании 1 м3 природного газа до СО2 и Н2О при коэффициенте избытке воздуха α=1,25. Необходимое количество кислорода для сжигания 1 м3 газа и состав дымовых газов определим по реакциям: 13
13
 = (V(возд) · с(возд) + Vвозд(Н2О) · с(Н2О)) · tn · x =
= (V(возд) · с(возд) + Vвозд(Н2О) · с(Н2О)) · tn · x =


