ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ ВЫБОРА МЕТОДА СИНТЕЗА
Классификация реагентов и реакций, механизмы реакций, энергетика, кинетика, влияние заместителей и растворителей.
При разработке оптимального плана синтеза субстанции лекарственного препарата необходимо использовать весь богатый арсенал методов органической химии, применительно к возможности их использования в технологически приемлемых условиях. Необходимо знать как сами методы, так и условия проведения реакций, закономерности их протекания, использующееся технологическое оборудование, способы выделения и очистки соединений. При рассмотрении закономерностей процессов, использующихся при разработке методов синтеза препарата, в первую очередь необходимо знать классификацию реагентов и реакций, механизмы реакций, их энергетику, кинетику, влияние заместителей и растворителей. Хорошо известно, что реакции протекают в результате эффективного соударения двух частиц. Атакуемую частицу называют субстратом реакции, атакующую – реагентом. Возможность прохождения реакции с точки зрения термодинамики контролируется изменением свободной энергии системы: DG = DH - TDS где DH, DS – энтальпийная и энтропийная составляющие. Если свободная энергия исходной системы выше свободной энергии продуктов реакции, то принципиально реакция может идти без подвода энергии извне. Однако при этом скорость реакции может быть ничтожно мала. Для того, чтобы осуществить реакцию с заметной скоростью, необходимо преодолеть энергетический барьер, называемый свободной энергией активации (DG ¹). При этом возникает переходное состояние или образуется промежуточное соединение либо конечный продукт. В переходном состоянии наблюдается частичное образование связи, в промежуточном соединении и конечном продукте возникает новая ковалентная связь. Эту ситуацию можно отразить с помощью энергетической диаграммы реакции. Для ряда реакций замещения в ряду ароматических соединений диаграмма имеет следующий вид:
1 - p-комплекс субстрата и реагента; 2 - s- комплекс;
1 2 3 Субстрат и реагент через небольшой барьер образуют p-комплекс, при преодолении более высокого энергетический барьера - s-комплекс и далее через один или два барьера (два - с получением преддиссоциативного p-комплекса) конечный продукт. В субстрате реакции чаще всего имеется несколько атомов, на которые может быть направлена атака реагента. Для образования связи необходимо электростатическое притяжение реакционных центров, то есть реагирующие атомы субстрата и реагента должны иметь различные по знаку заряды. Кроме того, на занятой молекулярной орбитали (ЗМО) электронодонорной молекулы необходимо иметь пару электронов, которая способна при сближении частиц взаимодействовать со свободной молекулярной орбиталью (СМО) (дыркой) электроноакцепторной молекулы. Рассмотрим реакцию между электронодонорной молекулой S и электроноакцепторной молекулой T. Занятая молекулярная орбиталь (ЗМО) молекулы S, содержащая пару электронов, взаимодействует со свободной орбиталью (СМО) молекулы T, в результате чего возникает новая связь:
Таким образом, для протекания реакции на атоме s, который является реакционным центром электронодонорной молекулы S, имеется пара электронов, отрицательный или частично отрицательный заряд и относительно большой коэффициент атомной орбитали (АО) высшей занятой молекулярной орбитали (ВЗМО). На реакционном центре t электроноакцепторной молекулы T имеется положительный или частично положительный заряд и относительно высокое значение коэффициента АО низшей свободной молекулярной орбитали (НСМО). ВЗМО и НСМО называют граничными орбиталями. По общей многоэлектронной теории возмущений (метод ВМО) изменение полной энергии DЕполн. при частичном образовании связи между атомами s и t молекул S и T в растворителе с эффективной диэлектрической константой e описывается следующим фундаментальным уравнением (уравнение Клопмана):
где qs и qt – полные заряды на атомах s и t; R st - расстояние между атомами s и t, для которых вычисляется энергия; Csm – коэффициенты АО ЗМО – m, атома s молекулы S; Ctn - коэффициенты АО СМО – n, атома t молекулы T; bD - изменение резонансного интеграла при взаимодействии орбиталей атомов s и t на расстоянии Rst; Em* и En* -энергии граничных орбиталей молекул S и T. При малом радиусе реагирующих частиц (величина R st мала) и большом заряде на реакционных центрах второй член уравнения (ковалентный член) вносит малый вклад в изменение энергии и им можно пренебречь. В этом случае реализуется зарядовый контроль протекания реакции. Если величина заряда на реагирующих атомах мала и разница между энергиями ВЗМО одной молекулы и НСМО другой незначительна, то электростатический член уравнения имеет малое значение. Наибольший вклад в изменение энергии вносит ковалентный член уравнения – орбитальный контроль протекания реакций. Для понимания влияния зарядов и величин энергий граничных орбиталей на механизм реакции привлечение этого уравнения полезно. По эмпирическому принципу жестких и мягких кислот и оснований (ЖМКО) Пирсона реагенты разделяют на три группы. Жесткие реагенты имеют малый радиус и высокий заряд, мягкие – большой радиус и невысокий заряд. Для промежуточных величины радиуса и заряда занимают среднее положение. Было показано, что энергетически выгодно взаимодействие жестких реагентов с жесткими, а мягких с мягкими. Анализ этой ситуации с помощью уравнения Клопмана показывает, что в первом случае наблюдается зарядовый контроль, а во втором – орбитальный. Позднее в качестве меры абсолютной жесткости (h) предложен количественный параметр, который равен полуразности потенциала ионизации (I) и сродства к электрону (А). В терминах теории МО величине I соответствует ЕВЗМО, а величине А – ЕНСМО. Таким образом, величина абсолютной жесткости может быть найдена по следующему уравнению: h = ЕВЗМО - ЕНСМО /2 (уравнение 2) В таблице приведены некоторые примеры кислот и оснований.
Таблица 1 Классификация кислот и оснований (в скобках приведена величина абсолютной жесткости h в эВ)
Из данных таблицы видно, что протон является жестким реагентом и его присоединение будет происходить к атомам, имеющим наибольший отрицательный заряд. В реакциях электрофильного замещения в ароматическом ряду участвуют жесткие реагенты, такие как NO2+, SO3, RSO3+, RCO+, Cl+. Для этих реакций характерен зарядовый контроль. Поведение реагентов в реакциях нуклеофильного замещения подробно будет рассматриваться в соответствующих разделах. Однако в качестве наглядного примера можно рассмотреть реакции нуклеофильного замещения в молекуле, содержащей мягкий центр - атом хлора и жесткий центр – атом фтора. С жестким основанием, каким является этилат анион, замещается атом фтора. С мягким реагентом – CH3S - реагирует атом хлора:
Таким образом, приведенная классификация регентов может быть полезна при разработке оптимального метода синтеза веществ. Ее использование позволяет выбрать субстраты, с помощью которых возможно региоселективное проведение процесса.
КЛАССИФИКАЦИЯ РЕАКЦИЙ В рассмотренных примерах наблюдается гетеролитический тип образования связи. Одна из классификаций реакций основывается на природе реагента - реакции электрофильного и нуклеофильного замещения. По механизму превращения различают также реакции присоединения реагентов к молекуле или отщепления заместителя от молекулы. Если реагирующие частицы содержат по одному неспаренному электрону, тип образования связи гомолитический (радикальные реакции). В особую группу выделяют перициклические реакции с циклическим переносом электронов, при котором нет заряженных или свободнорадикальных частиц. Примером служит реакция Дильса – Альдера. Различают по механизму также мономолекулярные и бимолекулярные реакции. Если, например, лимитирующей стадией процесса является разрыв связи в субстрате реакции и быстрое взаимодействие образовавшегося иона с другой молекулой, то реакции называют мономолекулярными. Если в лимитирующей стадии процесса участвуют две молекулы – бимолекулярные. По принятой номенклатуре реакции кратко обозначают с помощью букв и цифр, учитывающих тип реакции, реагент и число участвующих молекул. Первая буква – тип реакции: S (substitution), A (addition), E (elimination) – замещение, присоединение и отщепление. Вторым подстрочным символом обозначают тип реагента – N (nucleophilic), E (electrophilic), R (radical) – нуклеофильный, электрофильный и радикальный. Третий символ – цифра, 1 – мономолекулярные реакции, 2 – бимолекулярные. Например, SN1, SR2, SE2. Специфику реакций ароматических соединений обозначают – Ar. Так реакции электрофильного замещения в ароматическом цикле обозначают SE2Ar или более кратко - SEAr. Реакции, использующиеся в промышленном органическом синтезе, как правило, хорошо изучены. Это можно продемонстрировать на примере реакций электрофильного замещения в ряду ароматических и гетероароматических соединений SEAr. Механизм и закономерности проведения других процессов будут рассмотрены в соответствующих разделах. МЕХАНИЗМ И КИНЕТИКА РЕАКЦИЙ Реакции электрофильного ароматического замещения имеют общий механизм, который можно представить следующей схемой:
p-комплекс s- комплекс (s-аддукт) где: реагент Х+ - электрофильная частица, имеющая целочисленный или частично положительный заряд, а бензольный цикл является обобщенной формулой ароматического соединения; К1 - константа скорости прямой реакции образования s -аддукта, К - 1 – обратной реакции, К2 – константа скорости образования целевого продукта, К-2 – обратной реакции,:В – основание, связывающее уходящий протон. Для понимания закономерностей реакций полезно использовать формальный кинетический анализ. Рассмотрим общее кинетическое уравнение. Скорость реакции - увеличение концентрации конечного продукта во времени прямо пропорциональна константе скорости реакции - К2, концентрации s -аддукта и концентрации агента, связывающего уходящий протон: V= Накопления s -аддукта в реакционной массе не наблюдается. Поэтому текущую, стационарную концентрацию этого продукта можно вычислить, приравняв ее приход расходу: Скорость образования промежуточного продукта
Скорость расхода промежуточного продукта
Приравниваем правые части уравнений 4 и 5: K1 [ArH] [X+] = (K2 [B] + K-1) [ArHX+] (уравнение 6) После чего легко найти формулу расчета текущей концентрации сигма-аддукта:
Зная формулу расчета концентрации s- аддукта, выраженную через экспериментально определяемые величины, можно рассчитать скорость реакции:
С помощью анализа уравнения 8 довольно сложно проследить влияние реагентов на скорость процесса. Необходимо определить или знать лимитирующую стадию реакции. Во многих случаях величина К- 1 существенно меньше, чем К2[B] и этим слагаемым можно пренебречь. В связи с этим кинетическое уравнение существенно упрощается: V = k1[ArH][X+] (уравнение 9) Поэтому главными являются константа скорости реакции образования s -аддукта и концентрация электрофильной частицы. Энергетическая диаграмма реакции, графически отображающая этот вариант, приведена в начале раздела. Во втором случае лимитирующей стадией процесса является отрыв протона. Тогда K-1 >> K2[B] и последним слагаемым знаменателя можно пренебречь. Кинетическое уравнение имеет следующий вид:
В энергетической диаграмме реакции этого случая барьер отщепления протона выше, чем барьер образования s -аддукта. Отнесение процесса к первому или второму варианту может быть осуществлено с помощью измерения кинетического изотопного эффекта. Обычно кинетическим изотопным эффектом (КИЭ) называют отношение константы скорости реакции частицы, содержащей легкий изотоп, к константе скорости реакции частицы, содержащей тяжелый изотоп. Величина КИЭ определяется тем, что прочность связи между атомами зависит от массы соответствующего атома. В органическом синтезе обычно имеют дело с отщеплением изотопов атома водорода – протоном и дейтероном. Энергия разрыва связи C-D выше энергии разрыва связи C-H, поэтому дейтерозамещенные соединения реагируют медленнее, величина kH/kD может изменяться от 0,8 до 10. При соотношении kH/kD большем единицы, то есть когда наблюдается положительный КИЭ, стадия отрыва протона является лимитирующей. Если кинетический изотопный эффект отсутствует, то лимитирующей стадией процесса служит образование s -аддукта. Как следует из названия рассматриваемых реакций, скорость образования конечного продукта зависит от величины отрицательного заряда в ароматическом ядре. Влияние заместителей может быть оценено с помощью уравнения Гаммета. УРАВНЕНИЕ ГАММЕТА Для количественной оценки влияния заместителей Л. Гамметом, на основании принципа линейности свободных энергий, для ионизации замещенных бензойных кислот была найдена следующая зависимость: s x = lgK – lgK0 = -рКа + (рКа)0 (уравнение 11)
где: Х – заместитель в пара - или мета - положении, K0 – константа равновесия для бензойной кислоты (Х=Н), К – константа равновесия для замещенной бензойной кислоты (Х ≠ Н), s - константа заместителя, учитывающая как индуктивный, так и мезомерный эффект радикала Х. Следует отметить, что линейной зависимости от заместителей в орто- положении безойной кислоты не наблюдается. Таблица 2 s- Константы некоторых заместителей:
Известно, что для бензойной кислоты величина рКа = 4,21. Из уравнения 11 могут быть найдены величины рКа замещенных бензойных кислот. Так для п -нитробензойной кислоты рКа = 3,43; м - 3,50; п- метоксибензойной кислоты рКа = 4,48, а для м- производного рКа = 4,09. В последнем примере четко просматривается влияние как мезомерного, так и индуктивного эффекта. В м -метоксибензойной кислоте между заместителем и карбоксигруппой нет прямого полярного сопряжения – проявляется только индуктивный эффект, метоксигруппа является электроноакцепторной. В п - метоксибензойной кислоте уже есть сопряжение – метоксигруппа является электронодонором, кислота более слабая. Уравнение Гаммета может быть распространено и на химические реакции. Например, рассмотрим щелочной гидролиз этилбензоатов (85% водный этанол, 25оС). Этилбензоат и замещенные в цикле этиловые эфиры бензойной кислоты называют реакционной серией. Тогда вместо константы равновесия используется константа скорости реакции. И в обобщенном виде уравнение может быть представлено в следующем виде: lg где: K0 – константа скорости реакции для Х = Н,. К – константа скорости реакции для замещенных производных (Х ≠ Н), r - константа реакционной серии, s - константа заместителя. Величина r для ионизации бензойной кислоты принята равной 1. Использование данного уравнения полезно для оценки скорости реакции в п- и м -положениях цикла, а также для выбора условий проведения процесса. В тех случаях, когда в реакционном центре возникает целочисленный положительный заряд, используют s+ константу. При возникновении отрицательного заряда применяют s - константу. Для алифатических соединений Тафтом было разработано аналогичное уравнение, учитывающее стерический эффект заместителя (Es). Для ионизации производных уксусной кислоты найдены s* константы, в которых главную роль играет индуктивный эффект: lg В отличие от уравнения Гаммета, в уравнении Тафта s*Н = + 0,49, а величина s* для СН3- группы равна нулю. s-Константы заместителей. Таблица 3.
Важную роль для оценки влияния заместителей играет и константа r. Знак константы указывает на то, как влияют электронодонорные и электроноакцепторные заместители на константу скорости реакции. Для реакций нуклеофильного замещения в ароматическом ряду величина r имеет положительное значение, для реакций электрофильного замещения знак константы r имеет отрицательное значение, для свободнорадикальных и перициклических реакций величина r близка к единице. Абсолютное значение величины константы r также дает большую информацию химику. Так при реакции этилирования бензола и его производных (C2H5Br, GaBr3, C2H4Cl2, 25oC) величина r = - 2,4; при нитровании (CH3COONO2, (CH3CO)2O, 25oC) r = - 6,0; ацетилировании (CH3COCl, AlCl3, 25oC) значение r составляет - 9,1; бромировании (Br2, CH3COОН, 25oC) r = - 12,1. При расчете константы скорости реакции для замещенного бензола по уравнению Гаммета очевидно, что влияние заместителя в случае этилирования, в отличие от бромирования, незначительно. Чем меньше абсолютное значение константы r, тем меньше региоселективность реакции. Это можно продемонстрировать на примере хлорирования толуола в различных условиях. Реагент NaOCl, электрофильная частица Cl+, r = -6,0, при хлорировании хлором в уксусной кислоте r = -9,5; при хлорировании хлором в нитрометане r = -13 (температура 25оС для всех изучаемых реакций). В первом случае выход о - и п -изомеров составляет 95%, а м- изомера - 5%, во втором м- изомер образуется с выходом уже только 0,6%, а в условиях хлорирования в нитрометане его выход не более 0,1%. Таким образом меняя условия проведения процесса можно существенно увеличить его региоселективность. Изменение знака r при смене растворителя свидетельствует об изменении механизма реакции. Так при гидролизе арилсульфохлоридов до сульфокислот в воде величина r составляет – 0,30 (механизм реакции SN1), в водном ацетоне r= + 0,84 и механизм реакции становится уже SN2. Влияние растворителя будет подробно рассмотрено в следующих разделах. Полезен также анализ соотношения К п и К м для реакций электрофильного замещения: lg K п /K0 = s + n r, а lg K м /K0 = s м r, соотношение K п /K0 = nf, соотношение K м /K0 = mf, nf и mf – парциальные скорости реакции в п- и м- положения цикла. Таким образом, lg nf - lg mf = lg nf / mf = r(s+ п - s м ). Соотношение nf и mf позволяет оценить преимущественное направление реакции – вступление заместителя в о-, п- или м- положение цикла. Если принять величину К0 равной единице, то для замещенного соединения константу скорости реакции называют относительной - Котносит., и ее величину можно найти экспериментально. Используют метод конкурирующих реакций - проводят в одном реакционном сосуде взаимодействие реагента с эквимолекулярными количествами бензола и изучаемого производного бензола. Так были проведены реакции бензола и толуола, бензола и хлорбензола с нитрующей смесью, выделены продукты реакции и определены их выходы. Соотношение выхода нитротолуолов и нитробензола было 24,1:1 – это и есть Котносит.. Во втором случае соотношение выхода суммы изомерных нитрохлорбензолов и нитробензола составляло 3,3 10-2. Для многих реакционных серий эти данные является справочными. По величине Котносит. можно прогнозировать условия проведения реакции. Так, для хлорбензола необходимо использовать более жесткие условия, чем для бензола, например повышение температуры реакции на 20 – 30оС. Анализ реакционной способности с помощью Уравнения Гаммета и его модификаций для производных бензола и гетероциклических соединений не всегда дает надежные результаты. Для практической деятельности полезно использовать справочные данные по величинам r и s при выборе условий проведения реакций в ряду, где уже исследованы некоторые из производных, а также для повышения региоселективности процесса. При разработке плана синтеза важной задачей является определение места вступления заместителя в молекулу по одному из нескольких реакционных центров. Однако из-за разнонаправленного действия заместителей и (или) гетероатомов только исходя из рассмотрения индуктивного и мезомерного эффекта группировок не всегда удается разрешить поставленную задачу. Это возможно осуществить с помощью использования квантово - химических расчетов. Тем более что в настоящее время имеются доступные пакеты прикладных программ для их выполнения - MOPAC и HYPERCHEM, работа в которых позволяет провести расчеты с помощью полуэмпирических методов.
|


 DG
DG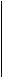
 Ордината – изменение свободной энергии системы реагентов, абсцисса– координата реакции,
Ордината – изменение свободной энергии системы реагентов, абсцисса– координата реакции, 3 – второй p-комплекс.
3 – второй p-комплекс.


 (уравнение 1)
(уравнение 1)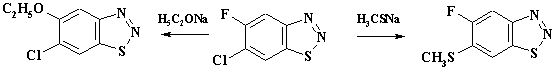
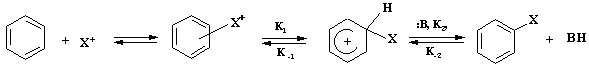 ,
, =K2 [Ar HX+][B] (уравнение 3)
=K2 [Ar HX+][B] (уравнение 3) = K1 [ArH] [X+] (уравнение 4)
= K1 [ArH] [X+] (уравнение 4)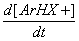 = K2[ArHX+][B] + K –1 [ArHX+] (уравнение 5)
= K2[ArHX+][B] + K –1 [ArHX+] (уравнение 5) (уравнение 7)
(уравнение 7) (уравнение 8)
(уравнение 8)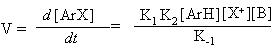 (уравнение 10)
(уравнение 10)
 = sr (уравнение 12)
= sr (уравнение 12)


