Термодинамические процессыТермодинамическое равновесие Фундаментальным для классической термодинамики является понятие термодинамического равновесия, которое тоже плохо поддаётся логическому определению и формулируется как обобщение экспериментальных фактов. Утверждается, что любая замкнутая термодинамическая система, для которой внешние условия остаются неизменными, с течением времени переходит в равновесное состояние, в котором прекращаются все макроскопические процессы. При этом в системе на микроскопическом уровне могут происходить самые разные процессы, например, химические реакции, которые могут протекать и в прямом, и в обратном направлении, однако в среднем эти процессы компенсируют друг друга, и макроскопические параметры системы остаются неизменными, флуктуируя относительно равновесного значения. Флуктуации изучаются в статистической физике. Термодинамические процессы При изменении внешних параметров или при передаче энергии в систему в ней могут возникать сложные процессы на макроскопическом и молекулярном уровне, в результате которых система переходит в другое состояние. Равновесная термодинамика не занимается описанием этих переходных процессов, а рассматривает состояние, устанавливающееся после релаксации неравновесностей. В термодинамике широко применяются идеализированные процессы, в которых система переходит из одного состояния термодинамического равновесия в другое, которые непрерывно следуют друг за другом. Такие процессы называются квазистатическими или квазиравновесными процессами[13]. Особую роль в методах термодинамики играют циклические процессы, в которых система возвращается в исходное состояние, совершая по ходу процесса работу и обмениваясь энергией с окружающей средой Нулевое начало термодинамики названо так потому, что оно было сформулировано уже после того, как первое и второе начало вошли в число устоявшихся научных понятий. Оно утверждает, что изолированная термодинамическая система с течением времени самопроизвольно переходит в состояние термодинамического равновесия и остаётся в нём сколь угодно долго, если внешние условия сохраняются неизменными[14][15]. Оно также называется общим началом[16]. Термодинамическое равновесие предполагает наличие в системе механического, теплового и химического равновесий, а также равновесия фаз. Классическая термодинамика постулирует лишь существование состояния термодинамического равновесия, но ничего не говорит о времени его достижения. Первое начало термодинамики выражает универсальный закон сохранения энергии применительно к задачам термодинамики и исключает возможность создания вечного двигателя первого рода, то есть устройства, способного совершать работу без соответствующих затрат энергии. Внутреннюю энергию U термодинамической системы можно изменить двумя способами, совершая над ней работу или посредством теплообмена с окружающей средой. Первое начало термодинамики утверждает, что теплота, полученная системой, идёт на увеличение внутренней энергии системы и на совершение этой системой работы, что можно записать как δQ = δA + dU. Здесь dU — полный дифференциал внутренней энергии системы, δQ — элементарное количество теплоты, переданное системе, а δA — бесконечно малая или элементарная работа, совершённая системой. Так как работа и теплота не являются функциями состояния, а зависят от способа перехода системы из одного состояния в другое, применяется запись с символом δ;, чтобы подчеркнуть, что δQ и δA — это бесконечно малые величины, которые нельзя считать дифференциалами какой-либо функции Второе начало термодинамики задаёт ограничения на направление процессов, которые могут происходить в термодинамических системах, и исключает возможность создания вечного двигателя второго рода. Фактически к этому результату пришёл уже Сади Карно в сочинении «О движущей силе огня и о машинах, способных развивать эту силу»[7][8]. Однако Карно опирался на представления теории теплорода и не дал ясной формулировки второго начала термодинамики. Это было сделано в 1850—1851 годах независимо Клаузиусом и Кельвином. Имеется несколько различных, но в то же время эквивалентных формулировок этого закона. Постулат Кельвина: «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счёт охлаждения теплового резервуара»[24]. Такой круговой процесс называется процессом Томсона-Планка, и постулируется, что такой процесс невозможен. Постулат Клаузиуса: «Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому»[25]. Процесс, при котором не происходит никаких других изменений, кроме передачи теплоты от холодного тела к горячему, называется процессом Клаузиуса. Постулат утверждает, что такой процесс невозможен. Теплота может переходить самопроизвольно только в одном направлении, от более нагретого тела к менее нагретому, и такой процесс является необратимым. Приняв за постулат невозможность процесса Томсона-Планка, можно доказать, что процесс Клаузиуса невозможен, и наоборот, из невозможности процесса Клаузиуса следует, что процесс Томсона-Планка также невозможен. Следствие второго начала термодинамики, постулированного в указанных формулировках, позволяет ввести для термодинамических систем ещё одну функцию термодинамического состояния S, названную энтропией, такую, что её полный дифференциал для квазистатических процессов записывается как dS=δQ/T [26]. В совокупности с температурой и внутренней энергией, введёнными в нулевом и первом началах, энтропия составляет полный набор величин, необходимых для математического описания термодинамических процессов. Лишь две из упомянутых трёх величин, которыми термодинамика пополняет список используемых в физике переменных, являются независимыми. Третье начало термодинамики или теорема Нернста утверждает, что энтропия любой равновесной системы по мере приближения температуры к абсолютному нулю перестает зависеть от каких-либо параметров состояния и стремится к определённому пределу[27]. Фактически содержание теоремы Нернста включает в себя два положения. Первое из них постулирует существование предела энтропии при стремлении к абсолютному нулю. Численное значение этого предела принято полагать равным нулю, поэтому в литературе иногда говорят о том, что энтропия системы стремится к нулю при стремлении температуры к 0 К. Второе положение теоремы Нернста утверждает, что все процессы вблизи абсолютного нуля, переводящие систему из одного равновесного состояния в другое, происходят без изменения энтропии[28]. Нулевые значения температуры и энтропии при абсолютном нуле приняты как удобные соглашения для устранения неоднозначности в построении шкалы для термодинамических величин. Нулевое значение температуры служит реперной точкой для построения термодинамической шкалы температур. Энтропия, обращающаяся в нуль при абсолютном нуле температуры, называется абсолютной энтропией. В справочниках термодинамических величин часто приводятся значения абсолютной энтропии при температуре 298,15 К, которые соответствуют увеличению энтропии при нагреве вещества от 0 К до 298,15 К.
где · · · · Так как
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона. Уравнение, выведенное Клапейроном, содержало некую неуниверсальную газовую постоянную
Менделеев же обнаружил, что
Уравнение Клапейрона — Клаузиуса — термодинамическое уравнение, относящееся к квазистатическим (равновесным) процессам перехода вещества из одной фазы в другую (испарение, плавление, сублимация, полиморфное превращение и др.). Согласно уравнению, теплота фазового перехода (например, теплота испарения, теплота плавления) при квазистатическом процессе определяется выражением
где Уравнение названо в честь его авторов, Рудольфа Клаузиуса и Бенуа Клапейрона. Элементарный вывод[править | править вики-текст]
Между температурой фазового перехода и внешним давлением существует функциональная связь, причём при фазовом переходе производная
Сообщённая теплота равна
где
Отсюда
Теоре́ма Эренфе́ста (Уравнения Эренфеста) — утверждение о виде уравнений квантовой механики для средних значений наблюдаемых величин гамильтоновых систем. Эти уравнения впервые получены П. Эренфестом в 1927 году. Формулировка теоремы[1]: В квантовой механике средние значения координат и импульсов частицы, а также силы, действующей на неё, связаны между собой уравнениями, аналогичными соответствующим уравнениям классической механики, то есть при движении частицы средние значения этих величин в квантовой механике изменяются так, как изменяются значения этих величин в классической механике. Уравнение Эренфеста для среднего значения квантовой наблюдаемой гамильтоновой системы имеет вид
где В частном случае, средние значения координаты
где Уравнения Эренфеста для средних координат и импульсов являются квантовыми аналогами системы канонических уравнений Гамильтона и задают квантовое обобщение второго закона Ньютона.
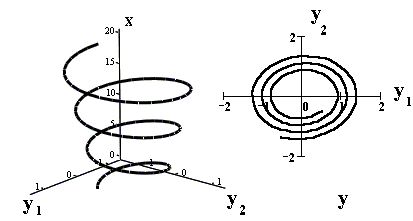
Рассмотрим систему обыкновенных дифференциальных уравнений n–го порядка Y ' = F (x, Y), и пусть вектор-функция Y = Φ;(x) — решение системы, определённое на промежутке [ a, b ]. Множество точек Φ;(x), x ∈ [ a, b ] — кривая в пространстве RY n. Эту кривую называют фазовой траекторией системы (или просто траекторией, или фазовой кривой), а пространство RY n, в котором расположены фазовые траектории, называют фазовым пространством системы.
Интегральная кривая системы определяется уравнением Y = Φ;(x), x ∈ [ a, b ], и изображается в (n +1)-мерном пространстве RY, xn +1. Фазовая траектория — это проекция интегральной кривой на пространство RY n. На рисунке изображена интегральная кривая в пространстве RY, x 2+1 и фазовая траектория в пространстве RY 2:
|

 ,
,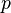 — давление,
— давление, — молярный объём,
— молярный объём,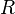 — универсальная газовая постоянная
— универсальная газовая постоянная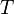 — абсолютная температура, К.
— абсолютная температура, К. , где
, где  — количество вещества, а
— количество вещества, а 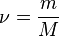 , где
, где  — масса,
— масса,  —молярная масса, уравнение состояния можно записать:
—молярная масса, уравнение состояния можно записать: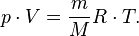
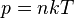 где
где 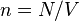 - концентрация атомов,
- концентрация атомов,  - постоянная Больцмана.
- постоянная Больцмана. , значение которой необходимо было измерять для каждого газа:
, значение которой необходимо было измерять для каждого газа:
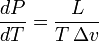
 — удельная теплота фазового перехода,
— удельная теплота фазового перехода,  — изменение удельного объёма тела при фазовом переходе.
— изменение удельного объёма тела при фазовом переходе.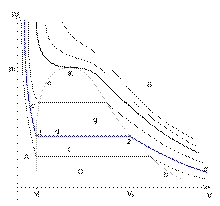
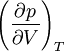 терпит разрыв. Тогда изотермы для рассматриваемого вещества будут иметь характерный вид, изображённый на рисунке. Для вывода существенен горизонтальный участок изотермы, соответствующий фазовому переходу. Слева и справа от этого участка всё вещество находится в одной фазе. Осуществим цикл Карно при бесконечно малой разности температур следующим образом: сначала сообщаем телу теплоту, переводя его из состояния 1 в состояние 2, затем адиабатически охлаждаем его на температуру dT, после чего замыкаем цикл, отводя теплоту и переводя вещество в фазу 1 с последующим адиабатическим нагревом. Совершённая работа равна площади цикла:
терпит разрыв. Тогда изотермы для рассматриваемого вещества будут иметь характерный вид, изображённый на рисунке. Для вывода существенен горизонтальный участок изотермы, соответствующий фазовому переходу. Слева и справа от этого участка всё вещество находится в одной фазе. Осуществим цикл Карно при бесконечно малой разности температур следующим образом: сначала сообщаем телу теплоту, переводя его из состояния 1 в состояние 2, затем адиабатически охлаждаем его на температуру dT, после чего замыкаем цикл, отводя теплоту и переводя вещество в фазу 1 с последующим адиабатическим нагревом. Совершённая работа равна площади цикла:


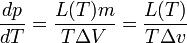
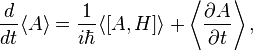
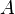 — квантовая наблюдаемая,
— квантовая наблюдаемая,  — оператор Гамильтона системы, угловыми скобками обозначено взятие среднего значения. Это уравнение может быть выведено из уравнения Гейзенберга.
— оператор Гамильтона системы, угловыми скобками обозначено взятие среднего значения. Это уравнение может быть выведено из уравнения Гейзенберга.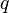 и импульса
и импульса  частицы описываются уравнениями
частицы описываются уравнениями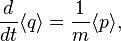
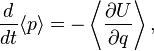
 — оператор потенциальной энергии частицы.
— оператор потенциальной энергии частицы.