Первый закон термодинамикиЕще в работах М. В. Ломоносова было дано общее обоснование принципа сохранения движения (энергии), что непосредственно связано с содержанием первого закона термодинамики. В установлении современной формы выражения первого закона термодинамики большую роль сыграли работы Г. И. Гесса (1836), Р. Майера (1842), Джоуля (1847), Гельмгольца (1847) и др. Можно дать несколько формулировок первого закона, которые по существу равноценны. Закон сохранения энергии в применении его к термодинамическим процессам является одним из таких выражений первого закона термодинамики. Как известно, закон сохранения энергии устанавливает, что если в каком-нибудь процессе энергия одного вида исчезает, то взамен ее появляется энергия в другой форме в количестве, строго эквивалентном первому. Любые переходы энергии соответствуют закону эквивалентности, т. е. разные формы энергии переходят друг в друга в строго эквивалентных, всегда одинаковых соотношениях. Отсюда вытекает, что в любой изолированной системе общий запас энергии сохраняется постоянным. Так как все виды энергии являются соответствующими формами движения материи, то закон сохранения энергии выражает неуничтожаемость движения. Эту неуничтожаемость движения следует понимать не только в количественном, но и в качественном смысле, т. е. как сохранение безграничной способности движения материи к качественным превращениям из одной формы в другую. Поскольку работа представляет собой одну из форм перехода энергии, то из указанных выше положений следует невозможность создания вечного двигателя (регреtum mobile) первого рода, т. е. такого механизма (машины), который бы давал возможность получить работу, не затрачивая на это соответствующего количества энергии. Иначе говоря, вечный двигатель первого рода невозможен. Большое значение имеет следующая формулировка первого закона, непосредственно вытекающая из постоянства запаса внутренней энергии изолированной системы. В любом процессе превращение внутренней энергии ∆U = U2 – U1 какой-нибудь системы равно количеству q сообщенной системе теплоты минус количество А работы, совершенной системой: ∆U = q - A все величины, разумеется, должны быть выражены в одинаковых единицах измерения). Это соотношение следует рассматривать как матемагическое выражение первого начала термодинамики. Пользуясь им, можно дать термодинамическое определение понятия внутренней энергии как величины, приращение которой в процессе равно сообщенной системе теплоте, сложенной с работой, совершенной над системой внешними по отношению к ней силами. Из трех величин, входящих в соотношение, только одна — изменение внутренней энергии ∆U — однозначно определяется начальным и конечным состояниями системы и не зависит от пути перехода. Остальные же две таким свойством не обладают. Каждая из них в отдельности зависит от способа совершения процесса, хотя разность их от этого не зависит. В качестве примера рассмотрим процесс зарядки и разрядки батареи аккумуляторов. Из закона сохранения энергии следует, что если мы при зарядке батареи до определенного состояния затрачиваем некоторое количество энергии, то при обратной разрядке до исходного состояния она отдаст то же количество энергии. Очевидно, что в зависимости от того, как будет производиться эта разрядка, выделение энергии может происходить в различных формах. Можно, например, всю энергию израсходовать на работу электромотора, который будет совершать механическую работу (подъем груза, сжатие газа с помощью компрессора и др.). В этом случае q = 0 и ∆U = —А. Можно разрядить батарею, соединяя ее с электронагревательными приборами, расходуя всю выделяющуюся энергию для получения теплоты. В этом случае А = О и ∆U = q. Или же можно какую-нибудь часть энергии израсходовать на получение работы, а другую часть на получение теплоты. Однако сумма полученной теплоты и произведенной работы будет одинаковой, если в разных случаях как начальные, так и конечные состояния аккумуляторов были одинаковы. Эта сумма равна убыли внутренней энергии системы и не зависит от пути ее перехода; она не зависит, в частности, от того, в обратимой или необратимой форме осуществлялись те или другие стадии процесса. Для процессов, связанных лишь с бесконечно малыми изменениями, уравнению удобно придать вид: ∆U = δq – δА где ∆U — полный дифференциал внутренней энергии системы; δq и δА — бесконечно малые количества теплоты и работы. Иногда удобней разложить всю работу, совершаемую системой, на отдельные составляющие в соответствии с различием сил, против которых она производится. При постоянном значении силы каждое из этих слагаемых равно произведению фактора интенсивности (или силы) на фактор емкости. Так, в изотермических процессах работа против внешнего давления при постоянном давлении равна рdv, где давление р — фактор интенсивности, а изменение объема dv — изменение фактора емкости. Обозначая эти силы через X, Y, Z... и соответствующие им факторы емкости через х, у, z … можно для случая, когда силы в ходе процесса остаются постоянными, придать уравнению следующий вид: dU = δq – (pdV + Xdx + Ydy + Zdz ….) Тепловой эффект этого процесса δ δ Из уравнения первого закона термодинамики вытекает ряд следствий. Так, в частности, для кругового процесса, (так как в нем ∆U = U2 - U1 = 0) всегда должно соблюдаться равенство q = А. Во многих процессах работа совершается только против внешнего давления. В этих случаях для изотермического процесса δA = pdv и уравнение принимает вид: dU = δq - pdv Для изохорных процессов (dv = 0) и уравнение приводит к равенству: δq = dU Из определения энтальпии имеем: dH = dU + рdv + vdр откуда для изобарных процессов (dр = 0) следует: dH = dU + рdv Выведенные соотношения показывают, что при постоянной температуре в изохорных процессах тепловой эффект ∆U равен изменению энергии, а в изобарных процессах тепловой эффект ∆H равен изменению энтальпии и не зависят от пути перехода и однозначно определяются начальным и конечным состояниями системы: ∆H = ∆U + р∆v Для идеальных газов произведение рv при постоянной температуре для данного количества газов постоянно. Произведение рv зависит от числа молей газа и для n молей газа рv = nрv = nRT. Следовательно, если в реакции расходуется n1 молей газообразных веществ, происходит образование n2 молей газообразных продуктов, то: ∆(pv) = (n2 –n1) RT = ∆nRT и, таким образом: ∆H = ∆U + ∆nRT
Если реакция происходит в конденсированных фазах, т. е. ни одно из исходных веществ или продуктов реакции не находится в газообразном состоянии, то различие между ∆H и ∆U незначительно и им большей частью можно пренебречь. Теперь можно вывести два важных соотношения для теплоемкостей. В общем случае истинная теплоемкость определяется как отношение бесконечно малого количества теплоты, сообщаемой телу, к тому изменению температуры, которое этим вызывается, т. е. С =
Cv = И для изобарных процессов соответственно: Cp = Оба эти равенства справедливы для любых веществ и для любого агрегатного состояния.
|

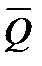 равен сумме выделенной теплоты (- δq) и всей работы δА, произведенной системой, за вычетом работы против внешнего давления рdv. Уравнение показывает, что когда все члены Xdx, Ydy, Zdz … или сумма их равны нулю, то тепловой эффект равен количеству выделенной теплоты (δQ = — δq). Наоборот, тепловой эффект не будет равен количеству выделившейся теплоты, если сумма членов Xdx + Ydy + Zdz …
равен сумме выделенной теплоты (- δq) и всей работы δА, произведенной системой, за вычетом работы против внешнего давления рdv. Уравнение показывает, что когда все члены Xdx, Ydy, Zdz … или сумма их равны нулю, то тепловой эффект равен количеству выделенной теплоты (δQ = — δq). Наоборот, тепловой эффект не будет равен количеству выделившейся теплоты, если сумма членов Xdx + Ydy + Zdz …  0. Однако всегда остается справедливым равенство:
0. Однако всегда остается справедливым равенство: = - (dU + pdv) =- δq + Xdx + Ydy + Zdz ….)
= - (dU + pdv) =- δq + Xdx + Ydy + Zdz ….) . Отсюда следует, что для изохорных процессов согласно уравнению:
. Отсюда следует, что для изохорных процессов согласно уравнению:
 P
P


