Моно- и поликристаллы
Твердые тела (кристаллы) характе- ризуются наличием значительных сил межмолекулярного взаимодействия и сохраняют постоянными не только свой объем, но и форму. Кристаллы имеют правильную геометрическую форму, которая, как показали рентгенографи- ческие исследования немецкого физи- ка-теоретика М. Лауэ (1879 — 1960), яв- ляется результатом упорядоченного расположения частиц (атомов, моле- кул, ионов), составляющих кристалл. Структура, для которой характерно регулярное расположение частиц с пе- риодической повторяемостью в трех измерениях, называется кристалли- ческой решеткой. Точки, в которых расположены частицы, а точнее — сред- ние равновесные положения, около ко- торых частицы совершают колебания, называются узлами кристаллической решетки. Кристаллические тела можно разде- лить на две группы: монокристаллы и поликристаллы. Монокристаллы — твердые тела, частицы которых образу- ют единую кристаллическую решетку. Кристаллическая структура монокрис- таллов обнаруживается по их внешней форме. Хотя внешняя форма монокри- сталлов одного типа может быть раз- личной, но углы между соответствую- щими гранями у них остаются постоян- ными. Это закон постоянства углов, сформулированный Монокристаллами является боль- шинство минералов. Однако крупные природные монокристаллы встречают- ся довольно редко (например, лед, по- варенная соль, исландский шпат). В на- стоящее время многие монокристаллы выращиваются искусственно. Условия роста крупных монокристаллов (чис- тый раствор, медленное охлаждение и т.д.) часто не выдерживаются, поэтому большинство твердых тел имеет мелко- кристаллическую структуру, т. е. состо- ит из множества беспорядочно ориен- тированных мелких кристаллических зерен. Такие твердые тела называются поликристаллами (многие горные породы, металлы и сплавы). Характерной особенностью моно- кристаллов является их анизотроп- ность, т.е. зависимость физических свойств — упругих, механических, теп- ловых, электрических, магнитных, оп- тических — от направления. Анизотропия монокристаллов объяс- няется тем, что в кристаллической ре- шетке различно число частиц, приходя- щихся на одинаковые по длине, но раз- ные по направлению отрезки (рис. 104), т.е. плотность расположения частиц кристаллической решетки по разным направлениям неодинакова, что и при- водит к различию свойств кристалла вдоль этих направлений. В поликрис- таллах анизотропия наблюдается толь- ко для отдельных мелких кристалли- ков, но их неодинаковая ориентация приводит к тому, что свойства поликри-
Рис. 104 тие трехмерной периодической струк- туры — пространственной решетки, или решетки Бравэ, представление о которой введено французским кристал- лографом О. Бравэ (1811-1863). Вся- кая пространственная решетка может быть составлена повторением в трех раз- личных направлениях одного и того же
сталла по всем направлениям в среднем одинаковы.
§71.Типыкристаллических твердых тел
Кристаллическая решетка может обладать различными видами симмет- рии. Симметрия кристаллической решетки — ее свойство совмещаться с собой при некоторых пространствен- ных перемещениях, например парал- лельных переносах, поворотах, отра- жениях или их комбинациях и т.д. Кристаллической решетке, как доказал русский кристаллограф Е. С. Федоров (1853-1919), присущи 230 комбина- ций элементов симметрии, или 230 раз- личных пространственных групп. С переносной симметрией в трех- мерном пространстве связывают поня-
структурного элемента — элементар- ной ячейки. Всего существует 14 типов решеток Бравэ, отличающихся по виду переносной симметрии. Они распреде- ляются по семи кристаллографиче- ским системам, или сингониям, пред- ставленным в порядке возрастающей симметрии в табл. 3.
2. Физический признак кристал- лов. В зависимости от рода частиц, рас- положенных в узлах кристаллической решетки, и характера сил взаимодей- ствия между ними кристаллы разделя- ются на четыре типа: ионные, атомные, металлические, молекулярные. Ионные кристаллы. В узлах крис- таллической решетки располагаются поочередно ионы противоположного знака. Типичными ионными кристал- лами является большинство галоидных соединений щелочных металлов
NaCl CsCl Рис. 105 Структуры решеток двух наиболее характерных ионных кристаллов — NaCl (решетка представляет собой две одинаковые гранецентрированные ку- бические решетки, вложенные друг в друга; в узлах одной из этих решеток на- ходятся ионы Связь, обусловленная кулоновски- ми силами притяжения между разно- именно заряженными нонами, называ- ется ионной (или гетерополярной). В ионной решетке нельзя выделить от- дельные молекулы: кристалл представ- ляет собой как бы одну гигантскую мо- лекулу. Атомные кристаллы. В узлах крис- таллической решетки располагаются нейтральные атомы, удерживающиеся в узлах решетки гомеополярными, или ковалентными, связями квантово-ме- ханического происхождения (у сосед- них атомов обобществлены валентные электроны, наименее связанные с ато- мом). Атомными кристаллами являют- ся алмаз и графит (два различных со- стояния углерода), некоторые неорга- нические соединения (ZnS, BeO и т.д.), а также типичные полупроводники — германий Ge и кремний Si. Структура решетки алмаза приведена на рис. 106, где каждый атом углерода окружен че- тырьмя такими же атомами, которые располагаются на одинаковых рассто- яниях от него в вершинах тетраэдров. Валентные связи осуществляются парами электронов, движущихся по ор- битам, охватывающим оба атома, и но- сят направленный характер: ковалент- ные силы направлены от центрального
Рис. 106 атома к вершинам тетраэдра. В отличие от графита решетка алмаза не содержит плоских слоев, что не позволяет сдви- гать отдельные участки кристалла, по- этому алмаз является прочным соеди- нением. Металлические кристаллы. В узлах кристаллической решетки располага- ются положительные ионы металла. При образовании кристаллической ре- шетки валентные электроны, сравни- тельно слабо связанные с атомами, от- деляются от атомов и коллективизиру- ются: они уже принадлежат не одному атому, как в случае ионной связи, и не паре соседних атомов, как в случае го-
Молекулярные кристаллы. В узлах кристаллической решетки располага- ются нейтральные молекулы вещества, силы взаимодействия между которыми обусловлены незначительным взаим- ным смещением электронов в элект- ронных оболочках атомов. Эти силы называют ван-дер-ваальсовыми, так как они имеют ту же природу, что и силы притяжения между молекулами, приводящими к отклонению газов от идеальности. Молекулярными кристаллами явля- ется, например, большинство органи- ческих соединений (парафин, спирт, резина и т.д.), инертные газы (Ne, В некоторых твердых телах одновре- менно может осуществляться несколь- ко видов связи. Примером может слу- жить графит (гексагональная решетка). Решетка графита (рис. 107) состоит из ряда параллельных плоскостей, в кото- рых атомы углерода расположены в вершинах правильных шестиугольни- ков. Расстояние между плоскостями более чем в два раза превышает рассто- яние между атомами шестиугольника. Плоские слои связаны друг с другом ван-дер-ваальсовыми силами. В преде- лах слоя три валентных электрона каж- дого атома углерода образуют ковален-
тную связь с соседними атомами угле- рода, а четвертый электрон, оставаясь «свободным», коллективизируется, но не во всей решетке, как в случае метал- лов, а в пределах одного слоя. Таким образом, в данном случае осуществля- ются три вида связи: гомеополярная и металлическая — в пределах одного слоя; ван-дер-ваальсова — между слоя- ми. Этим объясняется мягкость графи- та, так как его слои могут скользить от- носительно друг друга. Различие в строении кристалличес- ких решеток двух разновидностей угле- рода — графита и алмаза — объясняет различие в их физических свойствах: мягкость графита и твердость алмаза; графит — проводник электричества, алмаз — диэлектрик (нет свободных электронов) и т.д. Расположение атомов в кристаллах характеризуется также координацион- ным числом — числом ближайших од- нотипных с данным атомом соседних атомов в кристаллической решетке или молекул в молекулярных кристаллах. Для модельного изображения кристал- лических структур из атомов и ионов пользуются системой плотной упаков- ки шаров. Рассматривая простейший случай плотной упаковки шаров одинакового радиуса на плоскости, приходим к двум способам их расположения (рис. 108, а, б). Правая упаковка является более плотной, так как при равном числе ша- ров площадь ромба со стороной, равной стороне квадрата, меньше площади квадрата. Как видно из рисунка, разли- чие в упаковках сводится к различию координационных чисел: в левой упа- ковке координационное число равно 4, в правой — б, т. е. чем плотнее упаков- ка, тем больше координационное число. Рассмотрим, при каких условиях плотная упаковка шаров в пространстве
Рис. 108
может соответствовать той или иной кристаллической структуре, приводи- мой ранее. Начнем строить решетку со слоя шаров, представленных на рис. 108, б. Для упрощения дальнейших рас- суждений спроецируем центры шаров на плоскость, на которой они лежат, обо- значив их белыми кружками (рис. 109). На эту же плоскость спроецируем цент- ры просветов между шарами, которые обозначены на рис. 109 соответственно черными кружками и крестиками. Любой плотноупакованный слой будем называть слоем А, если центры его шаров расположены над светлыми кружками, слоем В — если над темны- ми кружками, слоем С— если над крес- тиками. Над слоем А уложим второй плотноупакованный слой так, чтобы каждый шар этого слоя лежал на трех шарах первого слоя. Это можно сделать двояко: взять в качестве второго слоя либо В, либо С. Третий слой можно опять уложить двояко и т. д. Итак, плот- ную упаковку можно описать как пос- ледовательность АВСВАС..., в которой не могут стоять рядом слои, обозначен- ные одинаковыми буквами.
Рис.110 Из множества возможных комбина- ций в кристаллографии реальное значе- ние имеют два типа упаковки: 1) двух- слойная упаковка АВАВАВ... — гекса- гональная плотноупакованная структу- ра (рис. 110); 2) трехслойная упаковка Кроме двух- и трехслойных упако- вок можно построить многослойные упаковки с большим
Если кристалл построен из атомов различных элементов, то его можно представить в виде плотной упаковки шаров разных размеров. На рис. 112
§ 72. Дефекты в кристаллах
Рассмотренные в § 71 идеальные кристаллические структуры существу- ют лишь в очень малых объемах реаль- ных кристаллов, в которых всегда име- ются отклонения от упорядоченного расположения частиц в узлах решетки, называемые дефектами кристалли- ческой решетки. Дефекты делятся на макроскопические, возникающие в процессе образования и роста кристал- лов (например, трещины, поры, инород- ные макроскопические включения), и микроскопические, обусловленные микроскопическими отклонениями от периодичности. Микродефекты делятся на точеч- ные и линейные. Точечные дефекты бывают трех типов: 1) вакансия — от- сутствие атома в узле кристаллической решетки (рис. 113, а); 2) междоузель- ный атом — атом, внедрившийся в междоузелыюе пространство (рис. 113, б); 3) примесный атом — атом приме- си, либо замещающий атом основного
вещества в кристаллической решетке (примесь замещения, рис. 113, в), либо внедрившийся в междоузельное про- странство (примесь внедрения, рис. 113,6; только в междоузлии вместо ато- ма основного вещества располагается атом примеси). Точечные дефекты на- рушают лишь ближний порядок в кри- сталлах, не затрагивая дальнего поряд- ка, — в этом состоит их характерная осо- бенность. Линейные дефекты нарушают даль- ний порядок. Как следует из опытов, механические свойства кристаллов в значительной степени определяются дефектами особого вида — дислокаци- ями. Дислокации — линейные дефек- ты, нарушающие правильное чередова- ние атомных плоскостей. Дислокации бывают краевые и вин- товые. Если одна из атомных плоско- стей обрывается внутри кристалла, то край этой плоскости образует краевую дислокацию (рис. 114, а). В случае вин- товой дислокации (рис. 114,6) ни одна из атомных плоскостей внутри кристал- ла не обрывается, а сами плоскости лишь приблизительно параллельны и смыкаются друг с другом так, что фак- тически кристалл состоит из одной атомной плоскости, изогнутой по вин- товой поверхности. Плотность дислокаций (число дислокаций, приходящихся на единицу площади поверхности кристалла) для совершенных монокристаллов состав- ляет 102—103 локации никогда не обрываются, они либо выходят на поверхность, либо раз- ветвляются, поэтому в реальном крис- талле образуются плоские или про- странственные сетки дислокаций. Дис- локации и их движение можно наблю- дать с помощью электронного микро- скопа, а также методом избирательно- го травления — в местах выхода дисло- кации на поверхность возникают ямки травления (интенсивное разрушение кристалла под действием реагента), «проявляющие» дислокации. Наличие дефектов в кристалличе- ской структуре влияет на свойства кри- сталлов, анализ которых проведем ниже.
§ 73. Теплоемкость твердых тел
В качестве модели твердого тела рас- смотрим правильно построенную кри- сталлическую решетку, в узлах которой частицы (атомы, ионы, молекулы), при- нимаемые за материальные точки, ко- леблются около своих положений рав- новесия — узлов решетки — в трех вза- имно перпендикулярных направлени- ях. Таким образом, каждой составляю- щей кристаллическую решетку части- це приписывается три колебательных степени свободы, каждая из которых, согласно закону равнораспределения энергии по степеням свободы (см. § 50), обладает энергией кТ. Внутренняя энергия 1 моль твердо- го тела
(R — молярная газовая постоянная). Молярная теплоемкость твердого тела
т.е. молярная (атомная) теплоемкость химическипростыхтел в кристалличес- ком состоянии одинакова (равна 3R) и не зависит от температуры. Этот закон был эмпирически получен французски- ми учеными П. Дюлонгом (1785 — 1838) и Л. Пти (1791 — 1820) и носит название закона Дюлонга и Пти.
т. е. равна сумме атомных теплоемкос- тей элементов, составляющих это со- единение.
Как показывают опытные данные (табл. 4), для многих веществ закон Дюлонга и Пти выполняется с доволь- но хорошим приближением, хотя неко- торые вещества (С, Расхождение опытных и теоретиче- ских значений теплоемкостей, вычис- ленных на основе классической теории, объяснили, исходя из квантовой теории теплоемкостей, А. Эйнштейн и П. Дебай.
§ 74. Испарение, сублимация, плавлениеикристаллизация.
|

 вым. Он сделал важный вывод о том, что правильная форма кристаллов свя- зана с закономерным размещением ча- стиц, образующих кристалл.
вым. Он сделал важный вывод о том, что правильная форма кристаллов свя- зана с закономерным размещением ча- стиц, образующих кристалл.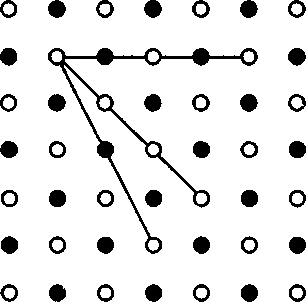 Таблица 3
Таблица 3 Существует два признака для клас- сификации кристаллов: 1) кристалло- графический; 2) физический (природа частиц, расположенных в узлах крис- таллической решетки, характер сил взаимодействия между ними).
Существует два признака для клас- сификации кристаллов: 1) кристалло- графический; 2) физический (природа частиц, расположенных в узлах крис- таллической решетки, характер сил взаимодействия между ними).
 Кристаллографический признак кристаллов. В данном случае важна только пространственная периодичность в расположении частиц, поэтому мож- но отвлечься от их внутренней струк- туры, рассматривая частицы как гео- метрические
Кристаллографический признак кристаллов. В данном случае важна только пространственная периодичность в расположении частиц, поэтому мож- но отвлечься от их внутренней струк- туры, рассматривая частицы как гео- метрические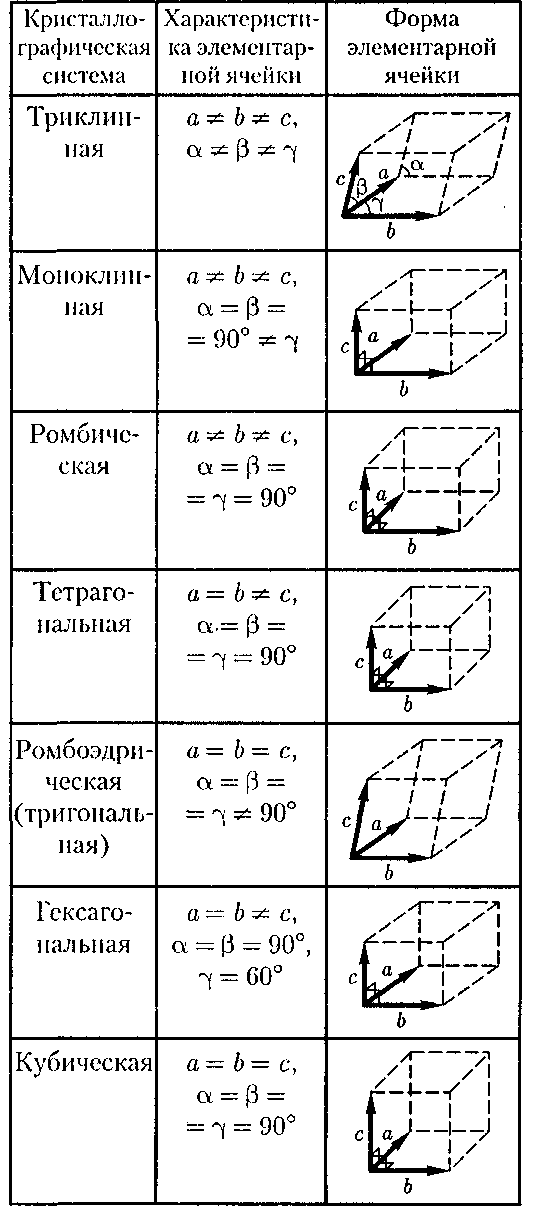

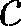
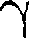
 Для описания элементарных ячеек пользуются кристаллографическими осями координат, которые проводят па- раллельно ребрам элементарной ячейки, а начало координат выбирают в левом углу передней грани элементарной ячей- ки. Элементарная кристаллическая ячейка представляет собой параллеле- пипед, построенный на ребрах
Для описания элементарных ячеек пользуются кристаллографическими осями координат, которые проводят па- раллельно ребрам элементарной ячейки, а начало координат выбирают в левом углу передней грани элементарной ячей- ки. Элементарная кристаллическая ячейка представляет собой параллеле- пипед, построенный на ребрах  с с углами а, (3 и между ребрами (табл. 3). Величины a, b и и а, (3 и называются параметрами элементарной ячейки однозначно ее определяют.
с с углами а, (3 и между ребрами (табл. 3). Величины a, b и и а, (3 и называются параметрами элементарной ячейки однозначно ее определяют.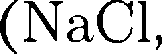

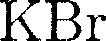 и т.д.), а также оксидов раз- личных элементов (MgO, CaO и т.д.).
и т.д.), а также оксидов раз- личных элементов (MgO, CaO и т.д.).
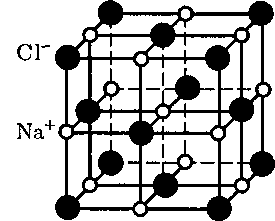
 в узлах другой — ионы
в узлах другой — ионы 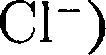 и CsCl (кубическая объемно центрированная решетка — в центре каждой элементарной решетки нахо- дится ион) — показаны на рис. 105. Силы взаимодействия между ионами являются в основном электростатиче- скими (кулоновскими).
и CsCl (кубическая объемно центрированная решетка — в центре каждой элементарной решетки нахо- дится ион) — показаны на рис. 105. Силы взаимодействия между ионами являются в основном электростатиче- скими (кулоновскими).
 связи, а всему кристаллу в целом. Таким образом, в металлах между положительными ионами хаоти- чески, подобно молекулам газа, дви- жутся «свободные» электроны, наличие которых обеспечивает хорошую элект- ропроводность металлов. Так как ме- таллическая связь не имеет направлен- ного действия и положительные ионы решетки одинаковы по свойствам, то металлы должны иметь симметрию вы- сокого порядка. Действительно, боль- шинство металлов имеет кубическую объемно центрированную (Li, Na, К, Rb, Cs) и кубическую гранецентрирован- ную
связи, а всему кристаллу в целом. Таким образом, в металлах между положительными ионами хаоти- чески, подобно молекулам газа, дви- жутся «свободные» электроны, наличие которых обеспечивает хорошую элект- ропроводность металлов. Так как ме- таллическая связь не имеет направлен- ного действия и положительные ионы решетки одинаковы по свойствам, то металлы должны иметь симметрию вы- сокого порядка. Действительно, боль- шинство металлов имеет кубическую объемно центрированную (Li, Na, К, Rb, Cs) и кубическую гранецентрирован- ную 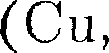 Ag, Pt, Аи) решетки. Чаще всего металлы встречаются в виде по- ликристаллов.
Ag, Pt, Аи) решетки. Чаще всего металлы встречаются в виде по- ликристаллов.
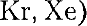 и газы
и газы  в твердом со- стоянии, лед, а также кристаллы бро- ма
в твердом со- стоянии, лед, а также кристаллы бро- ма  и иода
и иода 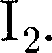 Ван-дер-ваальсовы силы довольно слабые, поэтому моле- кулярные кристаллы легко деформи- руются.
Ван-дер-ваальсовы силы довольно слабые, поэтому моле- кулярные кристаллы легко деформи- руются. Рис. 107
Рис. 107

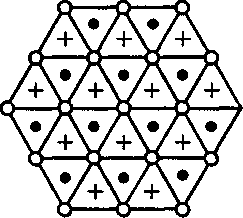 Рис. 109
Рис. 109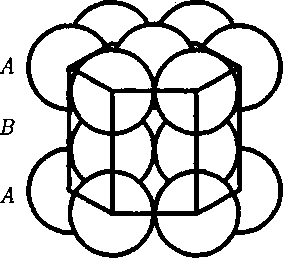
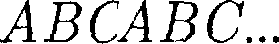 — кубическаягранецентри- рованная структура (рис. 111). В обеих решетках координационное число рав- но 12 и плотность упаковки одинако- ва — атомы занимают 74 % общего объе- ма кристалла. Координационное число, соответствующее кубической объемно центрированной решетке, равно 8, ре- шетке алмаза (см. рис. 106) равно 4.
— кубическаягранецентри- рованная структура (рис. 111). В обеих решетках координационное число рав- но 12 и плотность упаковки одинако- ва — атомы занимают 74 % общего объе- ма кристалла. Координационное число, соответствующее кубической объемно центрированной решетке, равно 8, ре- шетке алмаза (см. рис. 106) равно 4. повто- ряемости одинаковых слоев, например
повто- ряемости одинаковых слоев, например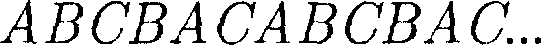 - шестислойная упаковка. Существует модификация карбида SiC с периодом повторяемос- ти 6, 15 и 243 слоя.
- шестислойная упаковка. Существует модификация карбида SiC с периодом повторяемос- ти 6, 15 и 243 слоя.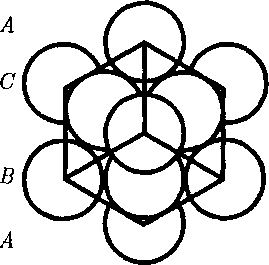 Рис.111
Рис.111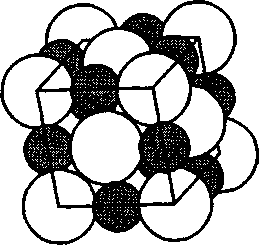 Рис. 112
Рис. 112 приведено модельное изображение кри- сталла поваренной соли. Крупные ионы хлора (г = 181 пм) образуют плотную трехслойную упаковку, у которой боль- шие пустоты заполнены меньшими по размеру ионами натрия
приведено модельное изображение кри- сталла поваренной соли. Крупные ионы хлора (г = 181 пм) образуют плотную трехслойную упаковку, у которой боль- шие пустоты заполнены меньшими по размеру ионами натрия  98 пм). Каждый ион Na окружен шестью иона- ми С1 и, наоборот, каждый ион С1 — шестью ионами Na.
98 пм). Каждый ион Na окружен шестью иона- ми С1 и, наоборот, каждый ион С1 — шестью ионами Na.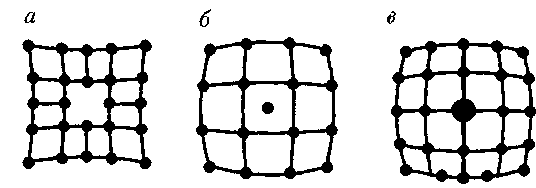

 Рис.113 Рис.114
Рис.113 Рис.114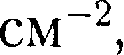 для деформирован- ных кристаллов — 1010—1012
для деформирован- ных кристаллов — 1010—1012 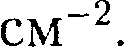 Дис-
Дис-
 где NA — постоянная Авогадро;.
где NA — постоянная Авогадро;.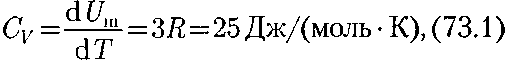
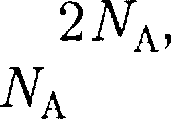 Если твердое тело является хими- ческим соединением (например, NaCl), то число частиц в 1 моль не равно по- стоянной Авогадро, а равно
Если твердое тело является хими- ческим соединением (например, NaCl), то число частиц в 1 моль не равно по- стоянной Авогадро, а равно  где п — число атомов в молекуле (для NaCl чис- ло частиц в 1 моль равно так, в 1 моль NaCl содержится атомов Na и
где п — число атомов в молекуле (для NaCl чис- ло частиц в 1 моль равно так, в 1 моль NaCl содержится атомов Na и  атомов С1). Таким образом, моляр- ная теплоемкость твердых химичес- ких соединений
атомов С1). Таким образом, моляр- ная теплоемкость твердых химичес- ких соединений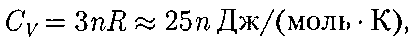
 Таблица 4
Таблица 4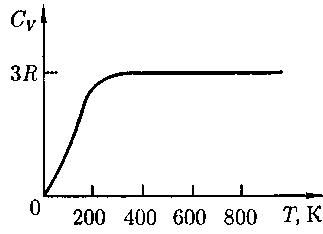 Рис.115
Рис.115 В) имеют боль- шие отклонения от вычисленных зна- чений теплоемкостей. Кроме того, так же как и в случае газов (см. § 53), опы- ты по измерению теплоемкости твер- дых тел при низких температурах по- казали, что она зависит от температу- ры (рис. 115). Вблизи нуля кельвин теп- лоемкость тел пропорциональна
В) имеют боль- шие отклонения от вычисленных зна- чений теплоемкостей. Кроме того, так же как и в случае газов (см. § 53), опы- ты по измерению теплоемкости твер- дых тел при низких температурах по- казали, что она зависит от температу- ры (рис. 115). Вблизи нуля кельвин теп- лоемкость тел пропорциональна  и только при достаточно высоких темпе- ратурах, характерных для каждого ве- щества, выполняется условие (73.1). Алмаз, например, имеет теплоемкость, равную 3R при 1800 К! Однако для большинства твердых тел комнатная температура является уже достаточно высокой.
и только при достаточно высоких темпе- ратурах, характерных для каждого ве- щества, выполняется условие (73.1). Алмаз, например, имеет теплоемкость, равную 3R при 1800 К! Однако для большинства твердых тел комнатная температура является уже достаточно высокой.


