Введение нового (рекомбинантного) гена в клеткуВведение нового гена в клетку можно провести двумя способами: используя вектор или путем прямого введения. Вектор — молекула ДНК или РНК, способная переносить включенные в нее чужеродные гены в клетку, где эти молекулы реплицируются автономно или после интеграции с геномом (хромосомой). Не каждая молекула ДНК или РНК может быть вектором. Векторы должны обладать определенными свойствами, в числе которых: 1. способность к автономной (т. е. независимо от хромосомы реципиента) репликации в клетке реципиента. Например, для репликации в клетке бактерии вектор должен содержать сайт ori (участок инициации репликации); 2. наличие области, в которую возможно встраивание необходимого фрагмента ДНК. Для этого вектор должен содержать один или более участков (сайтов рестрикции), чувствительных к определенным рестриктазам, которые расщепляют вектор и позволяют встроить желаемую последовательность нуклеотидов (трансген); 3. небольшой размер, так как при длине более 15 т. п. н. значительно снижается эффективность клонирования чужеродной ДНК; 4. наличие маркерных генов, позволяющих отличить трансформированные клетки от исходных. Это могут быть селективные (придающие клеткам устойчивость к антибиотикам, гербицидам) или репортерные (клетки удобно тестировать по изменению окраски продуктов этих генов) гены; 5. наличие соответствующего промотора, под который необходимо поместить чужеродный ген для экспрессии в клетке бактерии. Последовательности ДНК, расположенные перед началом структурного гена и определяющие степень активности РНК-полимеразы, называются регуляторными последовательностями. Одна из таких последовательностей представляет собой участок ДНК, с которым связывается РНК-полимераза. Этот участок называется промотором. Регуляторные последовательности эукариотических генов отличаются от прокариотических, и бактериальная РНК- полимераза не узнаёт их. Поэтому для экспрессии эукариотических генов в клетках прокариот нужно, чтобы гены находились под контролем бактериального промотора (т. е. промотора клетки-хозяина). В качестве промотора широко используют промотор гена, локализованного в коммерческих векторах, например pBR322, lac-промотор Е. coli и др. Таким образом создается вектор, т. е. создается целая генетическая конструкция, в состав которой, помимо трансгена, вводятся маркерные гены и соответствующие регуляторные последовательности. Типы векторов. В качестве векторных молекул могут служить плазмиды бактерий или дрожжей (простых эукариотических организмов), ДНК бактериофагов или вирусов, искусственные хромосомы дрожжей (YAK) и бактерий (ВАК). Созданы также гибридные (искусственные) векторы — фазмиды, объединяющие преимущества плазмид и фагов. Для клонирования небольших фрагментов ДНК используют плазмиды, фаговые ДНК, а для крупных — космиды и искусственные хромосомы. 1. Плазмиды. Основой для создания вектора обычно служат бактериальные плазмиды. Это небольшие внехромосомные, автономно реплицирующиеся кольцевые молекулы ДНК, которые в количестве нескольких копий содержатся в клетках бактерий. Природные плазмиды часто содержат гены, полезные для бактерий: придающие устойчивость к антибиотикам и ионам тяжелых металлов (R-плазмиды); контролирующие способность разрушать различные трудноразлагаемые токсические соединения (нафталин, камфару, толуол, ксилол, различные пестициды и др.); плазмиды биодеградации, или D-плазмиды. Некоторые плазмиды за счет специфического сайта инициации репликации могут реплицироваться в клетках только одного вида бактерий; это так называемые плазмиды с узким спектром хозяев. Другие плазмиды, с менее специфичным сайтом, могут реплицироваться в клетках разных видов бактерий; это плазмиды с широким спектром хозяев. Указанные особенности плазмид с успехом используют при создании векторов. Однако есть свойства, которые не позволяют природным плазмидам выступать в качестве вектора. Так, их размер может достигать от 1 т. п. н. до 500 т. п. н., т. е. размер в большинстве случаев значительно превышает допустимый. Кроме того, не все плазмиды несут в себе гены, которые могут служить маркерами для опознавания трансгенных клеток. Поэтому для эффективного трансгеноза приходится конструировать на основе плазмид с помощью методов генетической инженерии искусственные векторные системы (плазмидные векторы). В настоящее время предложен целый арсенал коммерческих векторов, созданных на основе бактериальных плазмид.
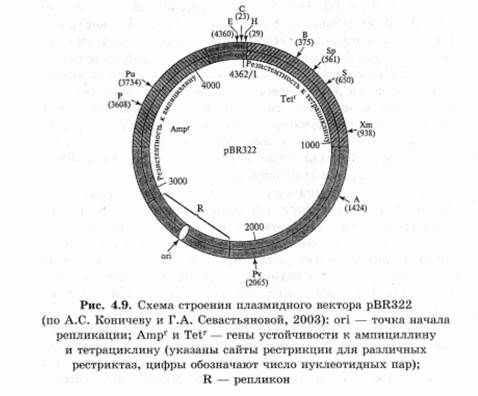
Например, плазмидный вектор pBR322 создан на основе плазмиды Е. coli (рис. 4.9). Плазмида pBR322 имеет сайт ori (область, ответственную за репликацию плазмиды), гены устойчивости к антибиотикам ампициллину и тетрациклину, причем в генах устойчивости к этим антибиотикам имеются сайты рестрикции. Если фрагмент чужеродной ДНК встраивается в один из генов устойчивости, то последний инактивируется. Следовательно, успешное встраивание фрагмента чужеродной ДНК в один из этих генов легко детектировать по исчезновению у бактерий устойчивости к данному антибиотику, так как при этом сохраняется устойчивость к другому антибиотику. То есть вектор дает возможность детектировать только те клоны бактерий, которые содержат рекомбинантную плазмиду. Строение векторов может быть разнообразным, но все они обязательно должны включать в себя несколько сайтов для встраивания фрагментов донорной ДНК и обеспечивать простую идентификацию трансформированных клеток. В плазмидах можно клонировать фрагменты ДНК размером не более 10 т. п. н. 2. Вирусы — самые маленькие и самые простые из всех патогенов. Они являются одними из главных кандидатов на роль векторов для введения чужеродной ДНК. Из них создают векторы на основе РНК, вироидоспецифичных ДНК, комбинации вироидоспецифичных ДНК с Ti-плазмидами. При вирусной инфекции каждая клетка может получить большое число копий чужеродного гена. ДНК можно встраивать так, чтобы она находилась под контролем сильного вирусного промотора, что обеспечит высокий уровень экспрессии гена, и его продукты будут более доступны для исследования. В генетической инженерии часто используют 358-промотор вируса мозаики цветной капусты. Этот промотор не обладает тканевой специфичностью и активен не только в клетках крестоцветных, но и в клетках растений других семейств. Вирус должен быть жизнеспособным после рекомбинирования его ДНК. Легче всего вирусы вводятся в бактерии. Недостаток вирусов как векторов заключается в их небольшой емкости. Кроме того, они заражают небольшой круг хозяев. 3. Челночные векторы — это плазмидные векторы, предназначенные для работы в клетках разных организмов (животных и бактерий). Чаще всего для клонирования генов используют векторы с одним сайтом репликации для работы с Е. coli. При необходимости использования других бактерий или эукариотических клеток в векторы встраивают второй сайт инициации репликации, обеспечивающий их работу и в других клетках. Именно такие векторные системы называются челночными. Наиболее распространенные векторы состоят из плазмиды pBR322 и интактного раннего района транскрипции ДНК вируса SV40, а нужный ген встраивается под контроль промотора поздних генов или дополнительного раннего промотора. Челночные векторные системы экспрессии разработаны для дрожжей, насекомых и клеток млекопитающих. Челночные векторы, созданные на основе бакуловирусов для работы в клетках Е. coli и насекомых, называются бакмидами. 4. Транспозоны — это сегменты ДНК, которые контролируют собственное перемещение из одного сайта ДНК в другой путем выхода из исходного сайта и внедрения в новый сайт хромосомы или плазмиды. Впервые транспозоны были открыты в 1940-х гг. американским ученым Барбарой Мак-Клинток у кукурузы. Транспозоны как бы передвигаются по всему геному растения. В течение многих лет кукуруза оставалась единственной системой, в которой обнаруживались такие подвижные генетические элементы. Сейчас они выявлены у бактерий, дрозофил и других организмов. Механизм перемещения фрагментов ДНК по геному до конца не выяснен. Поскольку подвижные гены могут перемещаться в пределах генома с одного места на другое, то они могут быть весьма эффективными векторами для передачи рекомбинантной ДНК. Генетическая трансформация с помощью векторов на основе транспозонов была впервые осуществлена на дрозофиле. С их помощью можно переносить довольно крупные участки ДНК. Этот метод переноса генов имеет значительные преимущества, так как он осуществляется с высокой частотой и не сопровождается значительными перестройками в интегрируемой ДНК. 5. Векторные системы, предназначенные для клонирования крупных фрагментов ДНК: — космиды — векторные системы, которые объединяют в себе участки плазмидных ДНК (ген-маркер и репликон плазмиды) и ДНК бактериофага. Термин обозначает, что вектор является плазмидой, внутри которой вставлен cos- участок фага A, (cos-site), представляющий собой нуклеотидную последовательность, отвечающую за упаковку фаговой ДНК в ее протеиновую капсулу. Космиды могут переносить до 40 т. п. н. клонируемой ДНК в клетки Е. coli;
— фазмиды — векторы, которые также представляют собой искусственные гибриды между фагом и плазмидой. В зависимости от условий, после встраивания чужеродной ДНК они могут размножаться как фаги или как плазмиды; — бактериальная искусственная хромосома (ВАС — от англ. bacterial artificial chromosomes) — также способна переносить участки чужеродной ДНК от 150 до 300 т. п. н. Служит для трансформации животных клеток; — дрожжевая искусственная хромосома (YAC — от англ. yeast artificial chromosomes) — сконструирована для переноса особо крупных участков чужеродной ДНК, вмещающих фрагменты геномной ДНК длиной от 100 т. п. н. до 1 м. п. н. Для их создания к плазмиде дрожжей «пришивают» центромерные последовательности, теломеры, последовательности для автономной репликации в дрожжевой клетке, сайты рестрикции и селективные маркеры. В качестве возможных векторов для переноса генов предполагается использовать хлоропластные и митохондриальные ДНК. Для идентификации трансформированных клеток, несущих рекомбинантную ДНК, вектор должен содержать один или несколько генов-маркеров. Выделяют две группы маркерных генов, позволяющих отличить трансформированные клетки от исходных, — это селективные и репортерные гены: — селективные гены — придают клеткам селективное преимущество, т. е. устойчивость к антибиотикам (канамицину, тетрациклину, неомицину и др.) или гербицидам (у растений). Основной принцип работы такого маркера — способность трансформированных клеток расти на селективной питательной среде с добавкой определенных веществ, ингибирующих рост и деление нетрансформированных, т. е. нормальных, клеток. Трансформанты отбирают на средах с высоким содержанием этих веществ. Например, в присутствии гена лактомазы бактериальная клетка приобретает устойчивость к ампициллину и на среде с этим антибиотиком образует клон (несущий данный ген), тогда как обычные клетки (без данного гена) на этой среде погибают; — репортерные гены — кодируют нейтральные для клеток белки, наличие которых в тканях легко обнаружить. В качестве репортерных чаще всего используют гены (3-глюкуронидазы (uidA, другое название — gus), зеленого флюоресцентного белка (gfp), люциферазы (1ис), хлорамфениколацетил- трансферазы (cat). Из них в большей степени применяют гены, кодирующие белки GUS и GFP, и в меньшей — кодирующие белки LUC и CAT. Ген uidA (gus) является модифицированным геном из Е. coli, кодирующим Р-глюкуронидазу. Он может гидролизовать обширный спектр природных и синтетических глюкуронидов, что позволяет подбирать соответствующие субстраты для спектрофотометрического или флюориметрического определения активности фермента, а также для гистохимического окрашивания тканей in situ (в синий цвет). В составе химерных белков, созданных генно-инженерными методами, GUS обычно сохраняет свою функциональную активность. GFP (green fluorescent protein — зеленый флюоресцентный белок) был обнаружен Т. Шимомурой и соавторами в 1962 г. у люминесцирующей медузы Aequorea victoria. Он обладает особым свойством — способен флюоресцировать в видимой (зеленой) области спектра при облучении длинноволновым УФ. Для проявления флюоресценции не требуется субстратов или кофакторов. Ген gfp был клонирован в 1992 г. Г. Прашером и соавторами. Благодаря свойству белка, gfp является очень перспективным репортерным геном, позволяет проводить разнообразные прижизненные (недеструктивные) исследования с трансгенными организмами. Определяется гистохимически, по изменению окраски ткани при добавлении соответствующего субстрата. Ген 1ис кодирует фермент люциферазу (клонирована из бактерий и светлячка). Люцифераза обеспечивает переход люциферинов из окисленной формы в основную, что вызывает свечение трансформированных клеток растений, накапливающих этот белок. Ген cat отвечает за синтез хлорамфениколацетилтрансферазы (выделен из Е. coli). Этот фермент катализирует реакцию переноса ацетильной группы от ацетил-КоА к хлорамфениколу. Определяется только радиоизотопными методами. Область применения селективных генов в основном связана с простым контролем трансгеноза. Репортерные гены позволяют выявлять (по возможности количественно) временные и пространственные особенности экспрессии данного конкретного гена (собственного или чужеродного). Присоединение репортерного гена к одной лишь промоторной области позволяет исследовать в «чистом виде» ее роль в регуляции экспрессии изучаемого гена на уровне транскрипции.
|