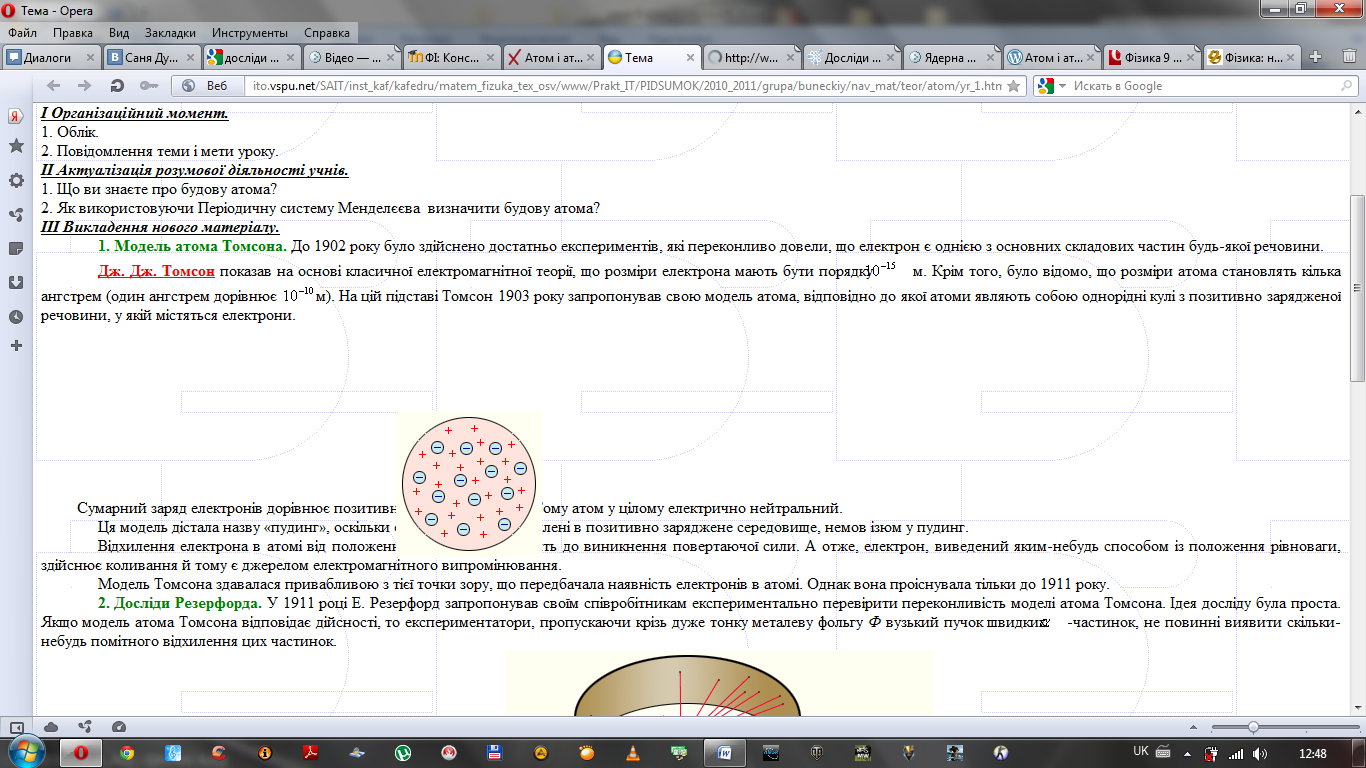
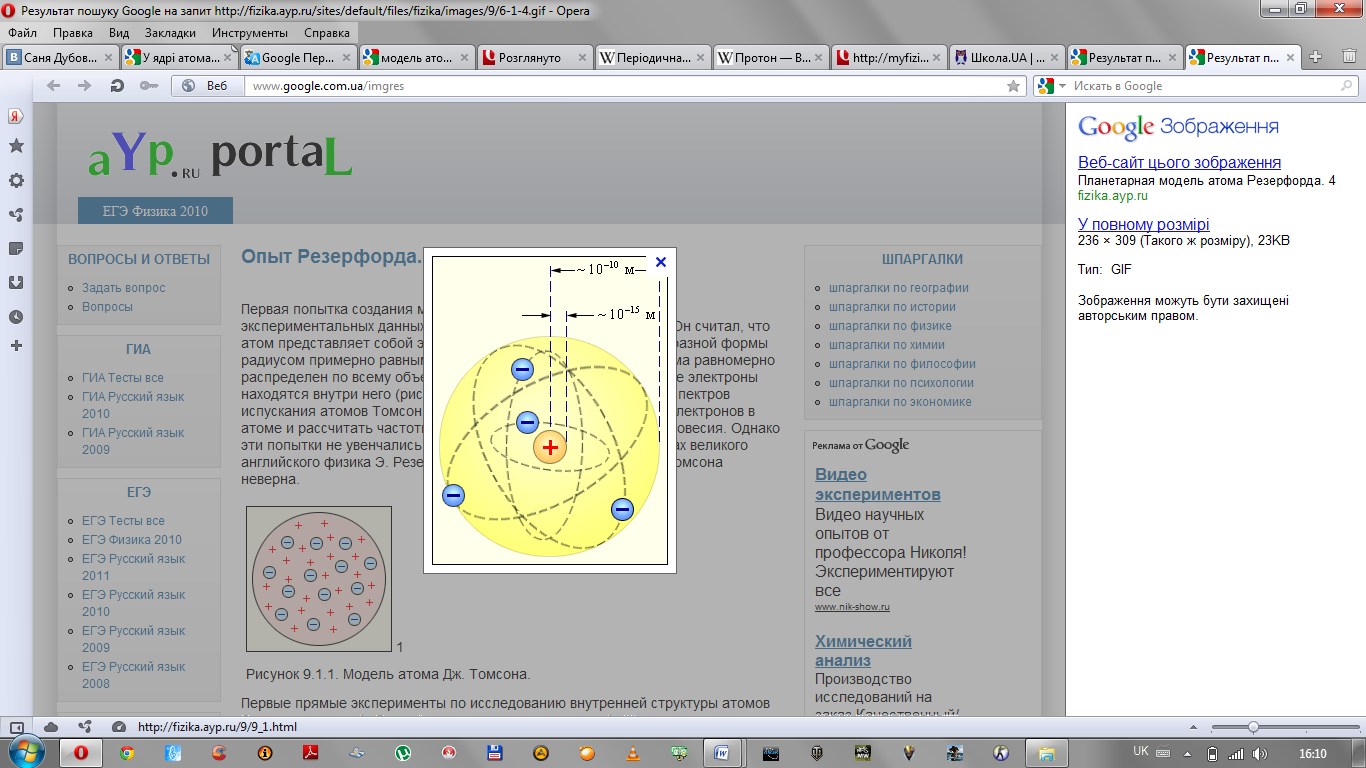
Структура уроку.І. Організаційний момент. 1. Облік. 2. Повідомлення теми і мети уроку. ІІ. Актуалізація розумової діяльності учнів. 1. З чого складаються речовини? 2. Що таке атом? 3. Що ви знаєте про будову атома? ІІІ. Викладення нового матеріалу. 1.Експерементальне підтвердження складної будови атома. Усі електричні явища – електризація тіл під час тертя, виникнення електричного струму в металах і напівпровідниках, свідчить про те, що до складу атома входять електрично зараджені частинки. Перші експериментальні результати, з яких можна було зробити висновок про складну будову атома, про наявність всередині нього електричних зарядів, були одержані М. Фарадеєм у 1833 р. під час вивчення законів електролізу. 2. Відкриття електрона у 1897 році Томсоном. В 1897 р. англійський фізик Дж. Дж. Томсон у результаті дослідів з вивчення електричного розряду в розріджених газах, термоелектронної емісії встановив, що при співударах атомів у плазмі електричного розряду, під час нагрівання речовини з атома будь-якого хімічного елемента вириваються однакові, негативно заряджені частинки. Ці частинки було названо електронами. У 1909 році американський фізик Р. Міллікен виміряв електричний заряд е окремих електронів. 3. Модель атома Томсона. До 1902 року було здійснено достатньо експериментів, які переконливо довели, що електрон є однією з основних складових частин будь-якої речовини. Джозеф Джон Томсон показав на основі класичної електромагнітної теорії, що розміри електрона мають бути порядку 10-15 м. Крім того, було відомо, що розміри атома становлять кілька ангстрем (один ангстрем дорівнює 10-10 м). На цій підставі Томсон 1903 року запропонував свою модель атома, відповідно до якої атоми являють собою однорідні кулі з позитивно зарядженої речовини, у якій містяться електрони. Сумарний заряд електронів дорівнює позитивному зарядові атома. Тому атом у цілому електрично нейтральний.
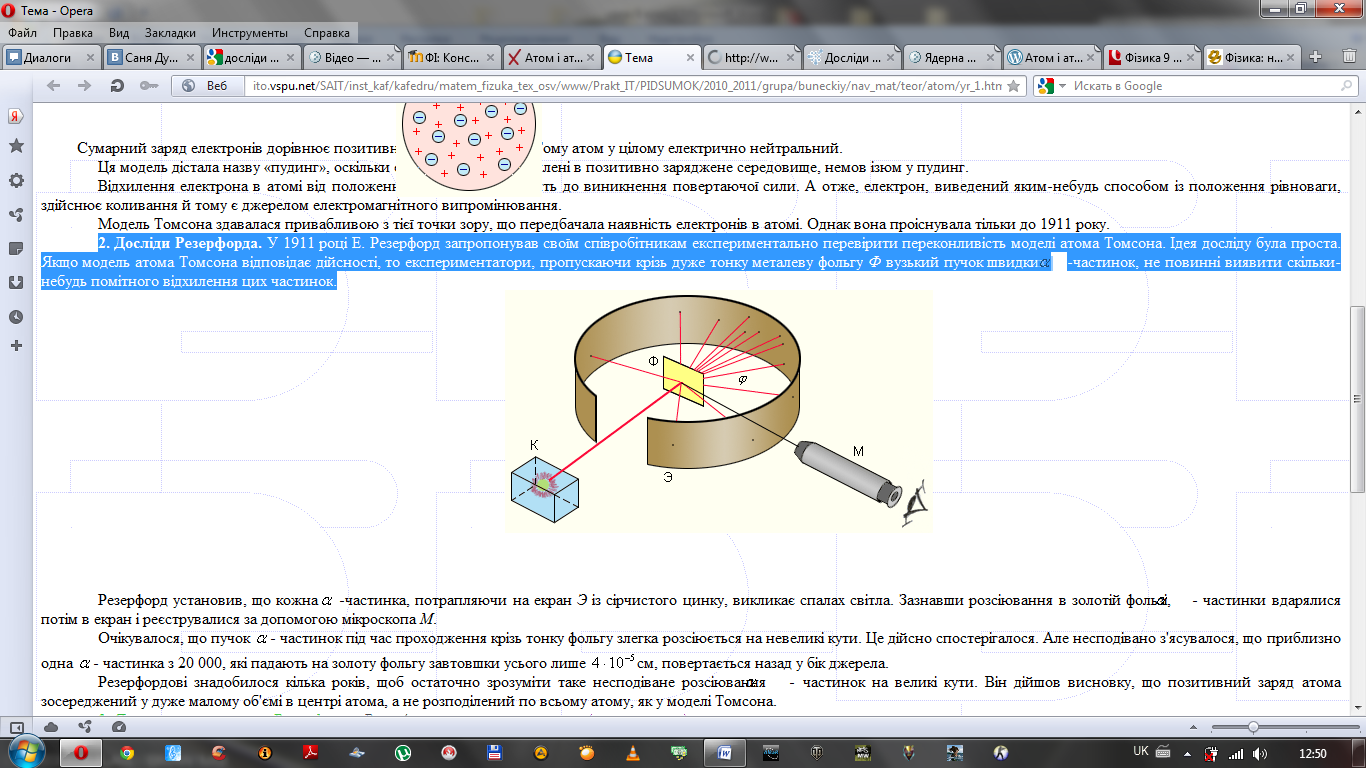
Ця модель дістала назву «пудинг», оскільки електрони були вкраплені в позитивно заряджене середовище, немов ізюм у пудинг. Відхилення електрона в атомі від положення рівноваги приводить до виникнення повертаючої сили. А отже, електрон, виведений яким-небудь способом із положення рівноваги, здійснює коливання й тому є джерелом електромагнітного випромінювання. Модель Томсона здавалася привабливою з тієї точки зору, що передбачала наявність електронів в атомі. Однак вона проіснувала тільки до 1911 року. 4. Досліди Резерфорда. У 1911 році Е. Резерфорд запропонував своїм співробітникам експериментально перевірити переконливість моделі атома Томсона. Ідея досліду була проста. Якщо модель атома Томсона відповідає дійсності, то експериментатори, пропускаючи крізь дуже тонку металеву фольгу Ф вузький пучок швидких А-частинок(Маса альфа-частинки складає 6,64 · 10-27 кг.), не повинні виявити якого-небудь помітного відхилення цих частинок.
Резерфорд установив, що кожна А-частинка, потрапляючи на екран Э із сірчистого цинку, викликає спалах світла. Зазнавши розсіювання в золотій фользі, А-частинки вдарялися потім в екран і реєструвалися за допомогою мікроскопа М. Очікувалося, що пучок А-частинок під час проходження крізь тонку фольгу злегка розсіюється на невеликі кути. Це дійсно спостерігалося. Але несподівано з'ясувалося, що приблизно одна А-частинка з 20 000, які падають на золоту фольгу завтовшки усього лише 4*10-15 см, повертається назад у бік джерела. Резерфордові знадобилося кілька років, щоб остаточно зрозуміти таке несподіване розсіювання А-частинок на великі кути. Він дійшов висновку, що позитивний заряд атома зосереджений у дуже малому об'ємі в центрі атома, а не розподілений по всьому атому, як у моделі Томсона. 5. Планетарна модель атома. Резерфорд запропонував планетарну модель атома: 1) атоми будь-якого елемента складаються з позитивно зарядженої частинки, що дістала назву ядра; 2) до складу ядра входять позитивно заряджені елементарні частинки — протони (пізніше було встановлено, що й нейтральні нейтрони); 3) навколо ядра рухаються електрони, що утворюють так звану електронну оболонку.
Необхідно зазначити, що атом, який утратив (чи набув) один або кілька електронів, уже не буде нейтральним, а матиме позитивний (або негативний) заряд. Його називають позитивним (або негативним) іоном. 6. Визначення складу атома та його ядра. Заряд атомного ядра дорівнює: qя = Z*e де e = -1,602*10-19 Кл; Z (зарядове число) – кількість протонів, електронів у ядрі. N = m – Z де N – кі-сть нейтронів; m – молекулярна маса атома;
ІV Закріплення. 1. Чим відрізняються один від одного атоми різних хімічних елементів? 2. Що є головною характеристикою певного хімічного елемента? 3. Які частинки входять до складу ядра? 4. Як утворюються позитивні й негативні іони? 5. Чому маса атома Гідрогену не значно відрізняється від маси протона? V. Задачі для розв’язання на уроці. 1. У ядрі атома карбону міститься 12 частинок. Навколо ядра рухаються 6 електронів. Скільки в ядрі цього атома протонів і нейтронів? 2. Яких частинок: протонів, нейтронів чи електронів буде більше у позитивному іоні літію? 3. Визначити заряд та склад ядра оксисену. VІ. Домашнє завдання § 34; № 16,5; 16,6; 16,9;
|

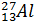 : N = 27-13= 14
: N = 27-13= 14


