ЭлектролизЭлектролизом называют совокупность гетерогенных окислительно-восстановительных реакций, протекающих в растворе или расплаве электролита на поверхности электродов, поляризованных анодно или катодно от внешнего источника тока. На электрод, поляризованный катодно (–), от внешнего источника тока поступают электроны. Вследствие этого у катода концентрируются противоионы (катионы) – потенциальные окислители. У электрода, поляризованного анодно (+), концентрируются анионы – потенциальные восстановители. В качестве окислителей и восстановителей при электролизе могут быть не только ионы, но и электронейтральные молекулы растворенных веществ. Потенциальным восстановителем может быть и металл, из которого изготовлен анод; в этом случае анод называют «активным». Обратите внимание, что в электролизере и гальваническом элементе анод и катод имеют обратные знаки: в гальваническом элементе анод имеет знак (–), а в электролизере знак (+); катод в гальваническом элементе (+), в электролизере (–). В то же время, есть одно общее в работе этих устройств: и в гальваническом элементе, и в электролизере на аноде протекают реакции окисления, а на катоде – реакции восстановления. Соответственно меняется и расчет
Как отмечалось ранее, наличие потенциальных окислителя и восстановителя является необходимым, но недостаточным условием для того, чтобы реакция между ними действительно протекала: необходимо, чтобы ЭДС реакции была положительной величиной. Например, рассчитаем ЭДС электролитического разложения воды:
К атодный процесс: 2H2O + 2е = H2 + 2OH– Е0 = – 0,41 В Анодный процесс: 2H2O = O2 + 4H+ + 4е Е0 = + 0,82 В
Таким образом, для электролитического разложения воды требуется ЭДС не менее 1,23 В. Если в растворе (расплаве) электролита имеются несколько веществ, способных окисляться или восстанавливаться, то, как и в обычных окислительно-восстановительных реакциях последовательность превращений на соответствующих электродах определяется величинами их электродных потенциалов: первым должен окисляться восстановитель с меньшим электродным потенциалом, а восстанавливаться – окислитель с большим электродным потенциалом. Выбор их для стандартных условий делают с помощью «Таблиц электродных потенциалов». При этом следует иметь в виду, что кроме энергетики превращения нередко определяющим оказывается кинетический фактор, в том числе и специфический для электрохимических реакций – явление «перенапряжения». Перенапряжение. В большинстве случаев для электрохимического превращения веществ ЭДС источника тока, подключаемого к электролизеру, должна быть больше ЭДС реакции. Причин этого много, но среди них есть специфическая, для случаев, когда продуктами электролиза оказываются газообразные вещества, чаще всего – молекулярные водород и кислород. Дело в том, что эти газы способны сорбироваться на поверхности многих металлов, образуя тонкую пленку, изолирующую электрод. Для того чтобы электролиз протекал с необходимой скоростью, требуется дополнительная ЭДС, которую называют перенапряжением. На некоторых металлах (Pb, Hg, Pt) перенапряжение превышает 1 В, и вследствие этого может существенно меняться последовательность восстановления (окисления) веществ на электродах. Например, при электролизе с ртутным катодом из водного раствора можно восстановить даже щелочные металлы (при этом есть еще одна особенность, не менее важная, чем перенапряжение: эти металлы, восстановившись, растворяются в ртути, образуют амальгаму, и оказываются вне контакта с водой). Вследствие того, что перенапряжение для кислорода больше, чем для хлора, при электролизе растворов хлоридов на аноде первыми окисляются хлорид-ионы, а не молекулы воды.
Рассмотрим несколько примеров электролиза. Пример 1. Определить, какие вещества окисляются на аноде и восстанавливаются на катоде при электролизе водного раствора сульфата калия с инертным анодом. Написать уравнения анодного и катодного процессов. Как меняется pН в процессе электролиза этого раствора? Решение: Определим состав электролита: K2SO4 ® 2K+ + SO42– H2O «H+ + OH– На положительно заряженном аноде могут окисляться молекулы воды или сульфат-ионы: Анод (+): 2H2O = O2 + 4H+ 4е Е0 = + 0,82 В 2SO42– = S2O82– + 2e Е0 = + 2,0 B Из двух потенциальных восстановителей более сильный – вода, т.к. ее окислению соответствует меньший электродный потенциал. На отрицательно заряженном катоде могут восстанавливаться ионы калия или водород из воды: Катод (–): K+ + е = К Е0 = – 2,92 В 2H2O + 2е = H2 + 2OH– Е0 = – 0,41 В Восстановлению водорода соответствует больший электродный потенциал, следовательно, вода – более сильный окислитель, и поэтому на катоде будет восстанавливаться водород из воды. Таким образом, при электролизе заданного раствора будут протекать реакции: Анод (+): 2H2O = O2 + 4H+ + 4е 1
Суммарное уравнение: 2H2O = O2 + 2H2
Как видно из уравнения реакции кислотность раствора (pH) при электролизе сульфата калия не меняется. Подобные варианты электролиза применяются в промышленности для получения водорода и кислорода из воды.
Примечание: Электродные потенциалы окисления оксоанионов неметаллов в высших степенях окисления гораздо больше, чем для окисления воды, поэтому их можно не рассматривать в качестве потенциальных восстановителей при электролизе водных растворов. Электродные потенциалы восстановления катионов щелочных и щелочноземельных металлов гораздо меньше, чем для восстановления водорода воды, поэтому в дальнейшем ихможно не рассматривать в качестве потенциальных окислителей при электролизе водных растворов.
Пример 2. Определить, какие вещества окисляются на аноде и восстанавливаются на катоде при электролизе водного раствора хлорида железа(III) с инертным анодом. Написать уравнения анодного и катодного процессов. Как меняется pН в процессе электролиза этого раствора? Решение: Определим состав электролита: FeCl3 ® Fe3+ + 3Cl– H2O «H+ + OH– На положительно заряженном аноде возможно окисление воды или хлорид-ионов: Анод (+): 2H2O = O2 + 4H+ + 4е Е0 = + 0,82 В 2Cl– = Cl2 + 2e Е0 = + 1,35 B Из двух восстановителей более сильный – тот, для которого электродный потенциал меньше, – это вода, поэтому энергетически более выгоден процесс восстановления воды. Однако, вследствие того, что перенапряжение для кислорода больше, чем для галогенов, и с учетом того, что анионы хлора быстрее мигрируют к аноду по сравнению с электронейтральными молекулами воды, на аноде будут преимущественно окисляться хлорид-ионы:
Анод (+): 2Cl– = Cl2 + 2e Е0 = + 1,35 B Какие вещества могут восстанавливаться на катоде? Катод (–): 2H2O + 2е = H2 + 2OH– E = – 0,41 B Fe3+ + e = Fe2+ E0 = + 0,77 B Имеются два потенциальных окислителя, H2O и Fe3+. Более сильный – тот, для которого электродный потенциал больше, – это Fe3+, Следовательно, на катоде будет восстанавливаться Fe3+, и тогда электролизу FeCl3 соответствуют следующие уравнения анодного и катодного процессов: Анод (+): 2Cl– = Cl2 + 2e– ç1 Катод (–): Fe3+ + e = Fe2+ ç 2 ________________________________ Суммарное уравнение: 2FeCl3 = 2FeCl2 + Cl2
Возможно ли дальнейшее восстановление железа Fe2+ + e = Fe? По справочным данным E0Fe2+/Fe = – 0,44 B. Вследствие того, что электродный потенциал этого превращения меньше, чем для восстановления воды, к тому же концентрация H2O гораздо больше, чем железа, после реакции Fe3+ + e = Fe2+ при продолжении электролиза будет преимущественно протекать реакция 2H2O + 2е = H2 + 2OH– При этом pH раствора должен увеличиваться. Однако, вследствие параллельно протекающей ионно-молекулярной реакции Fe2+ + 2OH– = Fe(OH)2 гидроксид-ионы связываются, pH раствора увеличится незначительно.
Пример 3. Определить, какие вещества окисляются на аноде и восстанавливаются на катоде при электролизе водного раствора сульфата никеля с никелевым анодом. Написать уравнения анодного и катодного процессов. Как меняется pH и концентрация соли в процессе электролиза этого раствора? Какие изменения будут в электролизе того же раствора, если анод заменить графитовым («пассивным»)? Напишите уравнения катодного и анодного процессов. Решение: Определим состав электролита: NiSO4 ® Ni2+ +SO42– H2O «H+ + OH– На положительно заряженном аноде возможно окисление воды и сульфат-ионов (последние исключим, см. примечание выше). Кроме того, возможно окисление самого анода: Анод (+): 2H2O = O2 + 4H+ + 4е Е0 = + 0,82 В Ni = Ni2+ + 2e Е0 = – 0,23 B Из двух потенциальных восстановителей более сильный тот, для которого электродный потенциал меньше – это никель (следовательно – это электролиз с активным анодом).
Какие вещества могут восстанавливаться на катоде? Катод (–): 2H2O + 2е = H2 + 2OH– E0 = – 0,41 B Ni2+ + 2e = Ni E0 = – 0,23 B Из двух потенциальных окислителей более сильный – ионы никеля, (электродный потенциал больше), поэтому на катоде будут восстанавливаться катионы никеля. Следовательно, уравнения анодного и катодного процессов электролиза раствора сульфата никеля будут следующие: Анод (+):Ni = Ni2+ + 2e Катод (–): Ni2+ + 2e = Ni Суммарное уравнение: Ni + Ni2+ = Ni2+ + Ni Ni + NiSO4 = NiSO4 + Ni
Таким образом, при электролизе этого раствора окисляется никелевый анод, а на катоде катионы никеля восстанавливаются. (Кислотность раствора не меняется). Подобные варианты электролиза применяются в промышленности для очистки («электрорафинирования») многих цветных металлов.
Что изменится, если никелевый анод заменить графитовым («пассивным») анодом? – Изменится анодный процесс: Анод (+): 2H2O = O2 + 4H+ + 4е и тогда электролизу будут соответствовать следующие уравнения: Анод (+): 2H2O = O2 + 4H+ + 4е Катод (–): Ni2+ + 2e = Ni Суммарное уравнение: 2H2O + Ni2+ = O2 + Ni + 4H+ 2H2O + NiSO4 = O2 + Ni + 2H2SO4 При таком варианте электролиза в растворе получается серная кислота, и pH раствора уменьшается.
|

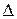 Е = ЭДС (в электролизе его называют потенциалом разложения вещества):
Е = ЭДС (в электролизе его называют потенциалом разложения вещества): Катод (–): 2H2O + 2е = H2 + 2OH– 2
Катод (–): 2H2O + 2е = H2 + 2OH– 2


