ТЕОРЕТИЧЕСКАЯ ЧАСТЬ. Химический эквивалент представляет собой одну из важнейших характеристик химического элементаХимический эквивалент представляет собой одну из важнейших характеристик химического элемента. Экспериментально установлено, что различные вещества реагируют друг с другом в определенных количественных соотношениях. Так, содержание водорода в воде составляет 11,11%, кислорода – 88,89 %. Это означает, что они реагируют между собой в массовом соотношении 1: 8, а в молярном соотношении 2: 1. Эти количества равноценны (эквивалентны) по отношению друг к другу. Эквивалентом элемента (Э) называют такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в соединении водорода с кислородом – воде (Н2О) – на 1 моль атомов приходится, как видно из формулы соединения, При определении эквивалента элемента необязательно исходить из его соединения с водородом. Эквивалент можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен. При расчетах используется эквивалентная масса Мэ – масса одного эквивалента. Она имеет размерность г/экв. В приведенных выше соединениях (Н2О, NH3) эквивалентные массы будут Мэ (Н) = 1 г/экв, Мэ (О) = 16: 2 = 8 г/экв, Мэ (N) = 14: 3 = 4,67 г/экв. Поскольку эквивалент измеряется в молях, то часто используется размерность г/моль. Эквивалентная масса элемента связана с мольной (атомной) массой элемента. Она равна мольной (атомной) массе, деленной на валентность элемента в данном химическом соединении. Мэ (элемента) = Эквивалентная масса может быть переменной величиной, так как зависит от валентности элемента в различных соединениях. Например, эквивалентная масса серы в разных соединениях: а) сероводороде H2S Мэ (S) = 32: 2 = 16 г/экв; б) оксиде серы (IV) SO2 Мэ (S) = 32: 4 = 8 г/экв; в) оксиде серы (VI) SO3 Мэ (S)= 32: 6 = 5,3 г/экв. Понятие об эквивалентах и эквивалентной массе распространяется и на сложные соединения (оксиды, кислоты, основания, соли). Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого элемента. Эквивалентная масса сложного вещества может иметь различные значения в зависимости от характера реакции, в которую вступает данное вещество, и от того, какой продукт при этом образуется. Эквивалентная масса кислоты Мэ (кислоты) равна молярной массе кислоты, деленной на основность кислоты (число атомов водорода, замещенных в данной реакции на металл). Мэ (кислоты) = Например, эквивалентная масса кислоты в реакции H2SO4 + KOH = KHSO4 + H2O; Мэ (Н2SO4) = а в реакции H2SO4 + Mg = MgSO4 эквивалентная масса той же кислоты вдвое меньше, так как в этой реакции замещено два катиона водорода: Мэ (H2SO4) = Эквивалентная масса основания Мэ (основания) равна молярной массе основания, деленной на кислотность этого основания (число гидроксогрупп, замещенных на кислотный остаток). Мэ (основания) = Например, эквивалентная масса основания Mg(OH)2 в реакции Mg(OH)2 + HСl = MgOHCl + H2O; Мэ (Мg(OH)2) = а в реакции Mg(OH)2 + 2HCl = MgCl2 + 2H2O эквивалентная масса того же основания в два раза меньше Мэ (Мg(OH)2) = Эквивалентная масса соли Мэ (соли) равна молярной массе соли, деленной на произведение валентности металла (ВМе) на число его атомов (n). Мэ(соли) = Например, Мэ (Na2SO4) = Эквивалентная масса оксида равна молярной массе оксида, деленной на произведение валентности элемента (Вэл) на число его атомов (n). Мэ (оксида) = Например, Мэ (Al2O3) = Молярную массу эквивалента любого сложного соединения можно определить по сумме эквивалентных масс составляющих его частиц. Например: а) молярная масса гидроксида натрия равна сумме молярных масс эквивалентов металла и гидроксогруппы, т.е. Мэ (основания) = Мэ (металла) + Мэ (гидроксогруппы); Мэ (NaOH) = Mэ (Na+) + Mэ (OH-) = 23 + 17 = 40 г/экв; б) эквивалентная масса кислоты равна сумме эквивалентных масс водорода и кислотных остатков Мэ (кислоты) = Мэ (Н+) + Мэ (кислотного остатка); Мэ (H2SO4) = Мэ (Н+) + Мэ (S в) эквивалентная масса соли равна сумме эквивалентных масс металла и кислотного остатка Мэ (соли) = Мэ (металла) + Мэ (кислотного остатка); Мэ (Al2(SO4)3) = Мэ (Al3+) + Mэ (S г) эквивалентная масса оксида равна сумме эквивалентных масс кислорода и элемента М э (оксида) = Мэ (элемента ) + Мэ (кислорода); Мэ (МgO) = Mэ (Mg2+) + Mэ (О2-) =
|

 моля атомов кислорода. Следовательно, эквивалент кислорода равен
моля атомов кислорода. Следовательно, эквивалент кислорода равен  моля атомов кислорода. В соединении водорода с азотом NH3 – на 1 моль атомов водорода приходится
моля атомов кислорода. В соединении водорода с азотом NH3 – на 1 моль атомов водорода приходится  моля атомов азота, следовательно, эквивалент азота в этом соединении равен
моля атомов азота, следовательно, эквивалент азота в этом соединении равен 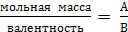 .
. 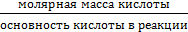 .
.  = 98 г/экв,
= 98 г/экв, = 49 г/экв.
= 49 г/экв.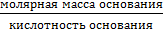 .
. 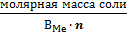 .
.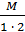 = 71 г/экв.
= 71 г/экв.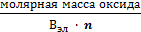 .
. 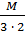 = 17 г/экв.
= 17 г/экв.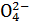 ) = 1 + 48 = 49 г/экв;
) = 1 + 48 = 49 г/экв;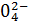 ) =
) = 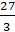 +
+ 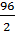 = 57 г/экв;
= 57 г/экв;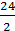 +
+ 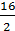 = 20 г/экв.
= 20 г/экв.


