Хімічні властивості кетонів
І. Реакції приєднання:
- Приєднання гідрогену: CH3–CO–CH3 + H2 → CH3CH(OH)–CH3
- Приєднання синільної кислоти: CH3–CO–CH3 + HCN → CH3–C(OH)(CN)–CH3
- Приєднання магнійгалогеналкілів: (H3C)2–CO + C2H5MgBr → (H3C)2–C(O–Mg–Br)–C2H5
- Приєднання гідросульфіту натрію: CH3–CO–CH3 + NaHSO3 → (H3C)2–C(OH)(SO3Na)
| ІІ. Реакції заміщення:
1. Взаємодія з PCl5: (H3C)–CO +PCl5 → CH3–CCl2–CH3 + POCl3
2. Реакція з аміаком: CH3–Cб+–Об—CH3 + H2NH → (CH3)2–C=NH + H2O
3. Для гідроксил аміну: (H3C)2–C=O +H2NOH → (H3C)2–C=N–OH + H2O
4. Взаємодія з гідразином:
(H3C)2–C=O + H2N–NH2 → (H3C)2–C=N–NH2 + H2O
5. Взаємодія з фенілгідразином:
(H3C)2–C=O + H2N–NH–C6H5 → (H3C)2–C=N–NH–C6H5 + H2O
| | ІІІ. Конденсація кетонів
CH3–Cб+–Об—CH3 + H–CH2–CO–CH3 ↔ (H3C)2–C(OH)–CH2–CH3 →
→ (H3C)2–C=CH–CO–CH3
| IV. Окиснення кетонів
(CH3)2–C=O + 3[O] → CH3–CO–OH + H–CO–OH
C2H5–CO–CH3 → a) 2CH3COOH
б) C2H5–COOH + HCOOH
|
Гмологічний ряд, номенклатура і фізичні властивості насичених карбонових кислот
| Формула
| Назва за номенклатурою
| Тпл, оС
| Ткип, оС
| РК25 (в Н2О)
| | Систематичною
| Історичною
| | O
//
H–C–OH
| Метанова
| Мурашина
| 8,4
| 100,7
| 3,75
| | O
//
H3C–C–OH
| Етанова
| Оцтова
| 16,7
| 118,1
| 4,76
| | O
//
H3C–CH2–C–OH
| Пропанова
| Пропіонова
| –22,0
| 141,1
| 4,87
| | O
//
H3C–(CH2)2–C–OH
| Бутанова
| Масляна
| –7,9
| 169,1
| 4,82
| | O
//
H3C–CH–C–OH
|
CH3
| 2-Метилпропанова
| Ізомасляна
| –47,0
| 154,4
| 4,86
| | O
//
H3C(CH2)3–C–OH
| Пентанова
| Валеріанова
| –34,5
| 187,0
| 4,86
| | O
//
H3C–CH–CH2–C–OH
|
CH3
| 3-Метилбутанова
| Ізовалеріанова
| –17,6
| 176,7
| 4,17
| | H3C–(CH2)4–COOH
| Гексанова
| Капронова
| –4,0
| 205,0
| 4,88
| | H3C–(CH2)5–COOH
| Гептанова
| Енантова
| –10,0
| 223,5
| 4,86
| | H3C–(CH2)14–COOH
| Гексадеканова
| Пальмітинова
| 64,0
| ––
| ––
| | H3C–(CH2)15–COOH
| Гептадеканова
| Маргаринова
| 60,6
| ––
| ––
| | H3C–(CH2)16–COOH
| Октадеканова
| Стеаринова
| 70,0
| ––
| ––
| Насичені одноосновні карбонові кислоти
Загальна формула – CnH2n+1COOH
Окремі представники
- Мурашина кислота НСООН
- Оцтова кислота СН3СООН
- Пропіонова кислота СН3–СН2–СООН
- Масляна кислота СН3–(СН2)2–СООН
- Валеріанова кислота СН3–(СН2)3–СООН
- Капронова кислота СН3–(СН2)4–СООН
- Енантова кислота СН3–(СН2)5–СООН
- Пальмітинова кислота СН3–(СН2)14–СООН
- Маргаринова кислота СН3–(СН2)15–СООН
- Стеаринова кислота СН3–(СН2)16–СООН
| Фізіологічна дія
Пари мурашиної кислоти подразнюють слизову оболонку. ГДК = 1мг/м3. Оцтова килота при с>2% небезпечна для очей. Деревний оцет може викликати екземи. ГДК = 5мг/м3. Концентровані кислоти викликають болючі опіки на шкірі.
| Способи одержання
(на прикладі оцтової кислоти)
- Промисловий метод
а) окиснення спирту під дією біологічних ферментів: CH3–CH2–OH + O2 →CH3COOH + H2O
б) пряме окиснення бутану:
2C4H10 + 5O2 → 4CH3COOH + H2O
в) з ацетилену по реакції Кучерова добувають оцтовий альдегід, який окиснюють до кислоти
г) реакція оксосинтезу: суха перегонка деревини (нагрівання без доступу повітря)
| | Фізичні властивості
В ряду насичених одноосновних карбонових кислот немає газоподібних речовин. Інші члени ряду (С1–С15) – рідини з гострим запахом, вищі кислоти – тверді речовини без запаху. Зі збільшенням молекулярної маси розчинність кислот і воді зменшується.
| ІІ. Лабораторні методи:
а) З хлор метану за допомогою ціаніду калію:
CH3Cl + KCN → CH3–CN + KCl;
CH3–CN + 2H2O → CH3COOH +NH3↑
б) З металоорганічних сполук:
CH3Li + CO2 → CH3COOLi;
CH3COOLi + HCl → CH3COOH + LiCl
в) За допомогою реактивів Гріньяра:
R–MgBr + CO2 → R–COOMgBr;
R–COOMgBr + H2O → R–COOH + Mg(OH)Br
г) Гідроліз нітрилів:
R–C≡N + 2H2O → R–COOH + NH3↑
| Якісні реакції
- Карбонові кислоти змінюють забарвлення індикаторів: метиловий оранжевий червоніє, лакмус стає рожевим, фенолфталеїн безбарвний.
- Мурашину кислоту можна виявити за такими ознаками:
а) під дією KmnO4 окислюється до вугільної кислоти
б) Взаємодіє з аміачним розчином оксиду срібла (реакція срібного дзеркала): НСООН + 2[Ag(NH3)2)OH → HCOONH4 + 2Ag↓ + 3NH3↑ + H2O
|
| Хімічні властивості насичених одноосновних карбонових кислот
| | Загальні
1. Утворення солей: 2CH3COOH + 2Na → 2CH3COONa + H2↑;
2CH3COOH + CaO → (CH3COO)2Ca + H2O;
CH3COOH +NaOH → CH3COONa + H2O;
2. Утворення ефірів: CH3COOH + R–OH → CH3COOR + H2O
3. Утворення ангідридів та хлорангідридів:
CH3COOH + PCl5 → CH3COOCl + POCl + HCl;
CH3COONa + CH3–(C=O)–Cl → (CH3–(C=O)–)2O
4. Взаємодія з галогенами: CH3COOH + Cl2 → CH2ClCOOH + HCl 5. Взаємодія з аміаком: CH3COOH + NH3 → CH3COONH4;
CH3COONH4 + t oC → CH3–(C=O)–NH2
6. Відновлення: CH3COOH + LiAlH4 → CH3–CH2–OH
| Специфічні
Мурашина кислота містить в своєму складі і альдегідну і карбоксильну групу. Тому вона має деякі специфічні властивості, зокрема є добрим відновником:
HCOOH + Cu(OH)2 → HO–(C=O)–OH + Cu2O + H2O;
HO–(C=O)–OH ↔ CO2↑ + H2O;
HCOOH + 2[Ag(NH3)2]OH → H–CO–O–NH4 + 2Ag + 3NH3↑ + H2O;
HCOOH + t oC + H2SO4 → CO + H2O
|
Двохосновні карбонові кислоти.
| Радикали
Загальна формула CnH2n(COOH)2 – це формула насичених двохосновних карбонових кислот. Найпростішим представником цього ряду є щавелева кислота НООС–СООН, найближчий її гомолог малонова кислота HOOC–CH2–COOH, в якої карбоксильні групи розділені групою –CH2–. Продовжуючи послідовно ланцюг на групу –CH2– можна отримати ряд двохосновних кислот, наприклад:
HOCO–(CH2)2–COOH – янтарна (бутадіонова) кислота
HOCO–(CH2)3–COOH – глутарова (пентадіонова) кислота
HOCO–(CH2)4–COOH – адипінова (гексадіонова) кислота
HOCO–(CH2)5–COOH – пімелінова (гептадіонова) кислота
HOCO–(CH2)6–COOH – пробкова (октадіонова) кислота
HOCO–(CH2)7–COOH – селезіанова (нонадіонова) кислота
HOCO–(CH2)8–COOH – себацинова (декандіонова) кислота
| Дія на організм людини.
Карбонові кислоти діють на організм людини тим сильніше, чим вища константа їхньої дисоціації. Токсичність ангідридів, галоген ангідридів органічних кислот також пов'язана з утворенням на вологих слизових оболонках кислот, які сильно подразнюють тканин. Щавелева кислота викликає тяжкі отруєння при вдиханні або ковтанні пороху. В тяжких випадках може викликати послаблення серцевої діяльності і судороги. ГДК = 1мг/м3
| Способи одержання.
Загальні методи одержання двохосновних кислот, аналогічні способам одержання одноосновних карбонових кислот.
Наприклад:
- Окислення первинних двохатомних спиртів
- Гідроліз (омилення) динітрилів
- Окиснення оксикислот
| | Фізичні властивості
Двохосновні кислоти – це безбарвні кристалічні речовини, розчинні у воді. В змінах температур їх плавлення в гомологічному ряді, як і в випадку одноосновних спостерігається певна періодична закономірність. Температура плавлення кислот з парним числом вуглецевих атомів вища температур плавлення сусідніх кислот з непарним числом вуглецевих атомів.
Наприклад: адипінова кислота (СН2)4(СООН)2 має Тпл = 153 оС, а глутарова (СН2)3(СООН)2 має Тпл = 97,5 оС.
| Якісні реакції
- Реагентом служить NaHCO3, NaOH, AgNO3. Розчинення в розчині NaHCO3 з виділенням газоподібного СО2
2. AgNO3 утворює білий осад погано розчинної срібної солі: Ag–OOC–COO–Ag↓ + 2HNO3
|
Хімічні властивості двохосновних карбонових кислот
               1. Реакції декарбоксилювання:
HOOC–COOH → HCOOH + CO2↑
HOOC–CH2–COOH → CH3–COOH + CO2↑
HOOC–CRR'–COOH → (R–)(R'–)CH–COOH +CO2↑
2. Утворення складних етерів:
HOOC–COOH + 2ROH → ROOC–COOR + 2H2O
3. Утворення циклічних ангідридів:
HOOC–(CH2)2–COOH → OOC–(CH2)2– COO
O 1. Реакції декарбоксилювання:
HOOC–COOH → HCOOH + CO2↑
HOOC–CH2–COOH → CH3–COOH + CO2↑
HOOC–CRR'–COOH → (R–)(R'–)CH–COOH +CO2↑
2. Утворення складних етерів:
HOOC–COOH + 2ROH → ROOC–COOR + 2H2O
3. Утворення циклічних ангідридів:
HOOC–(CH2)2–COOH → OOC–(CH2)2– COO
O
| 4. Піроліз кальцієвих або барієвих солей адипінової, пілемінової і пробкової кислот:
O
//
H2C–CH2–C–O H2C–CH2
| Ca → CaCO3 + | C=O
H2C–CH2–C–O H3C–CH2
\\
 O
Сіль адипінової кислоти Циклопентенон
O
// O
Сіль адипінової кислоти Циклопентенон
O
//
 CH2–CH2–C–O CH2–CH2 CH2–CH2–C–O CH2–CH2
 H2C Ca → CaCO3 + CH2 C=O
CH2–CH2–C–O CH2–CH2 H2C Ca → CaCO3 + CH2 C=O
CH2–CH2–C–O CH2–CH2
  \\
O
Сіль пімелінової кислоти Циклогексанон \\
O
Сіль пімелінової кислоти Циклогексанон
|
Похідні карбонових кислот. Ангідриди.
| Ангідриди карбонових кислот
Можна роглядати як продукт міжмолекулярного відщеплення води від двох молекул карбонових кислот за рахунок гідроксилів їх карбоксильних груп
| Способи добування
1 При взаємодії солей карбонових кислот з галоген ангідридами:
R–(C=O)–Na + R–(C=O)–Cl → R–(C=O)–O–(C=O)–R + NaCl
2. Прямою дегідратацією (в кислому середовищі): R–(C=O)–OH → R–(C=O)–O–(C=O)–R + H2O
| | Загальна формула
R–(C=O)–O–(C=O)–R, або (R–(C=O)–)2O
| Хімічні властивості
1. Реакція гідролізу: (R–(C=O)–)2O + H2O + H+ → 2R–(C=O)–OH 2. Реакція алкоголізу: (R–(C=O)–)2O + R'OH +H+ → R–(C=O)–O–R' + R–(C=O)–OH 3. Реакція амонолізу: (R–(C=O)–)2O + 2NH3 → R–(C=O)–NH2 + R–(C=O)–O–NH4
| | Фізичні властивості
Ангідриди нижчих карбонових кислот мають гострий запах. Ангідриди вищих карбонових кислот – кристалічні речовини без запаху.
| | Застосування
За хімічними властивостями ангідриди виступають як гарні ациліруючі реагенти.
|
Похідні карбонових кислот. Галогенангідриди.
| Представники
– Хлорангідрид мурашиної кислоти (хлористий форміл)
– Хлорангідрид оцтової кислоти (хлористий ацетил)
– Хлорангідрид пропіонової кислоти (хлористий пропіоніл)
| Дія на організм людини
Галоген заміщені аліфатичні кислоти проявляють значно більшу токсичність і припікаючи дію, а також подразнюючу дію. Так наприклад трифтороцтова кислота викликає дистрофічні зміни в легенях, печінці, мозку тварин.
Має подразнюючу і припікаючи дію. ГДК = 2мг/м3. Для хлороцтової кислоти ГДК = 1мг/м3
| Способи одержання
1. Взаємодія карбонових кислот з фосфор галогені дами: RCOOH + PCl5 → RCOCl + POCl3 + HCl 2. Взаємодія карбонових кислот з SOCl2: RCOOH + SOCl2 → RCOCl +SO2 + HCl
| | Фізичні властивості
Із галоген ангідридів важливе значення мають хлорангідриди. Нижчі хлорангідриди являють собою безбарвні леткі рідини з різким запахом, подразнюють слизові оболонки; вищі хлорангідриди – безбарні кристалічні речовини. Наприклад хлористий ацетил – легко кипляча рідина з Ткип= 52оС
| Хімічні властивості
1. Реакція гідролізу: RCOCl + HOH → RCOOH + HCl 2. Реакція алкоголізу: RCOCl + R'–OH → R–(C=O)–O–R' + HCl 3. Реакція амоналізу: RCOCl + NH3 → RCONH2 + HCl
|
Складні естери
| Представники
HCOOCH3 – метилформіат
HCOOC2H5 – етилформіат
CH3COOCH3 – метилацетат
CH3COOC2H5 – етилацетат
CH3COOC3H7 – н-н-пропілацетат
CH3–(CH2)2–(C=O)–O–C5H11 – масляноаміловий етер
| Спопоби одержання
1. Реакція естерифікації: R–(C=O)–OH + H+ ↔ R–(C=OH+)–OH + HOCH3 ↔ R–C(OH)2–HO+–CH3; R–C(OH)2–HO+–CH3 ↔ R–(C=O)–OH+–CH3 + H2O; R–(C=O)–OH+–CH3 ↔ R–(C=O)–O–CH3 + H+ 2. Дія спиртів на хлорангідриди: CH3–(C=O)–Cl + HO–C2H5 → CH3–(C=O)–O–C2H5 + HCl 3. Реакція Тищенко: 2CH3–(C=O)–H + NaOH → CH3–CO–ONa + CH3–CO–OH 4. Із галагенопохідних і срібних солей карбонових кислот: CH3–CO–O–Ag + Cl–CH3 → CH3–(C=O)–O–CH3 + AgCl 5. Із ангідридів: (CH3–(C=O)–)2O + HO–C2H5 → CH3–CO–O–C2H5 + CH3COOH
| | Фізичні властивості
Складні етери добре розчиняються в спирті і органічних розчинниках, добре кристалізуються. Леткі етери – це речовини з характерним фруктовим запахом: етил форміат – запах рому, амілформіат – запах вишні, оцтово ізоаміловій етер – запах груш.
| | Дія на організм людини
Оцтоволініловий етер – рідина, що аолодіє сльозоточивою дією. Багато складних етерів використовуються в медицині, при виробництві медичних препаратів.
| Хімічні властивості
1. Гідроліз (омилення): CH3–CO–O–C2H5 + HOH → CH3COOH + C2H5OH 2. Перестерифікація (алкоголіз): CH3–CO–O–C2H5 + CH3OH → CH3CO–O–CH3 + C2H5OH 3. Амоноліз: CH3–CO–O–C2H5 + NH3 → CH3–CO–NH2 + C2H5OH 4. Відновлення: CH3–CH2–CO–O–CH3 + 2H2 → CH3–CH2–CH2OH + CH3OH 5. Взаємодія з гідразином: CH3–CO–O–C2H5 + H2N–NH2 → CH3–CO–NH–NH2 + C2H5OH
|
Аміди карбонових кислот R–CO–NH2
| Представники
H–(C=O)–NH2 – формамід
CH3–(C=O)–NH2 – ацетамід
H–(C=O)–N(CH3)2 – диметилформамід
H2N–(C=O)–NH2 – карбамід (сечовина)
| Способи одержання
1. Пропускання парів кислот разом з аміаком над каталізатором: R–COOH + NH3 → R–CO–NH2 + H2O 2. Неповний гідроліз нітрилів: R–C≡N + H2O + H2O2 → R–(C=O)–NH2
| Хімічні властивості
1. Утворення кислот: R–(C=O)–NH2 + HCl + H2O → RCOOH + NH4Cl 2. Утворення солей: R–(C=O)–NH2 + NaOH → R–COONa + NH3↑ 3. Утворення нітрилів: CH3–CO–NH2 + P2O5 → CH3–C≡N + H2O 4. Відновлення амідів: R–CO–NH2 + відновник → R–CH2–NH2 5. Перегрупування Гофмана: R–CO–NH2 + NaOCl + 2NaOH → R–NH2 + Na2CO3 + NaCl + H2O
| | Фізичні властивості
Аміди кислот – кристалічні речовини. Формамід – рідкий (аміж мурашиної кислоти)
| | Карбамід H2N–CO–NH2
| | Фізичні властивості
Карбамід (сечовина) – тверда кристалічна речовиа, добре розчиння у воді, важче в спирті, не розчиняється в ефірах, вуглеводнях
| Способи одержання
1. Із СО2 і NH3 при нагріванні під тиском: CO2 + NH3 → H2N–COONH4 → (H2N)2–CO + H2O 2. Із фосгену і аміаку: Cl–CO–Cl + 4NH3 → H2N–CO–NH2 + 2NH4Cl 3. Із ціаніда: H2N–CN + H2O → H2N–CO–NH2
| Хімічні властивості
1. Реакція гідролізу: H2N–CO–NH2 + HOH → 2NH3↑ + CO2↑ 2. Взаємодія з нітратною кислотою: H2N–CO–NH2 + HNO3 → H2N–CO–NH2*HNO3
|
Нітрили карбонових кислот R–C≡N
| Представники:
CH3–C≡N – ацетогітрил (нітрил оцтової кислоти, або метилціанід)
CH2=CH–C≡N – акрилонітрил (нітрил акрилової кислоти, або вінілціанід)
| Способи одержання
1. Дією калій ціаніду на галагенопохідні: RBr + KCN → R–C≡N + KBr
2. Нагріванням амідів кислот або оксидів альдегід-дів з водовіднімаючими речовинами: R–(C=N–OH)–H → R–C≡N + H2O 3. Дегідратація амідів Al2O3: R–COOH + NH3 → R–C≡N + 2H2O 4. При взаємодії амідів з POCl3 або з P2O5: R–(C=O)–NH2 + P2O5 → R–C≡N + H2O 5. Алкілування натрій, або калій ціанідів: R–Cl + NaCN → R–C≡N + NaCl
| Хімічні властивості
1. Реакція гідролізу: а) в килому середовищі: R–CN + H2O + H+ → R–COO– + NH4+ б) в лужному середовищі: R–CN + NaOH + H2O → R–COONa + NH3↑ 2. Гідрування: R–C≡N + 2H2 → R–CH2–NH2 3. Гідроліз: R–C≡N + H2O → R–(C=NH)–OH → R–(C=O)–NH2
| | Фізичні властивості
Нітрили – це безбарвні речовини, перші представники ряду мають слабкий своєрідний запах і розчиняються в воді.
|
Тіоспирти R–S–H і сульфіди R–S–R
| Представники
CH3SH – метилмеркаптан, або метантіол.
C2H5SH – етилмеркаптан, або етан тіол
H3C–CH(SH)–CH3 – ізопропілмеркаптан, або пропантіол–2
HS–CH2–CH2–SH – 1,2–стандітіол
H3C–S–CH3 – диметилсульфід, або метилтіометан
H3C–S–C2H5 – метилетилсульфід, або метилтіоетан
Н5С2–S–C2H5 – діетилсульфід, або етилтіоетан
Н7С3–S–C2H5 – етилпропілсульфід, або 1–етилтіопропан.
| Фізіологічна дія
Тіоспирти в невеликих концентраціях в повітрі викликають головний біль через неприємний запах.
Тіоефіри (сульфіди) діють подібно до тіоспиртів. Збуджують, а потім пригнічують центральну нервову систему, викликаючи глибокий наркоз при відповідних концентраціях, а також зміни у внутрішніх органах
| Способи одержання
1. Реакція алкілгалогенідів з NaSH: C2H5Br + NaSH → C2H5SH + NaBr 2. Пропускання парів спиртів і H2S над нагрітим каталізатором (торій оксид, при 450ОС): ROH + H2S → R–SH + H2O 3. Взаємодія алкенів з H2S в кислому середовищі: CH3–CH=CH2 + H2S → CH3–CH(SH)–CH3 ___________________________________________
Тіоефіри добувають взаємодією галогеналканів з натрій сульфідом, або калій сульфідом і меркаптидами лужних металів: 2H3C–CH2–J + K2S → H3C–CH2–S–CH2–CH3 + 2KJ
H3C–CH2–S–Na + J–CH2–CH3 →
→ H3C–CH2–S–CH2–CH3 + NaJ
| | Фізичні властивості
Нижчі меркаптани – рідини з неприємним запахом. Вищі – тверді речовини. Тіоспирти важко розчиняються у воді і легко – в багатьох органічних розчинниках.
Тіоефіри (сульфіди) – рідини з температурою кипіння, близькою до температури кипіння тіоспиртів з з такою самою молекулярною масою. Тіоефіри не розчиняються у воді і мають кфірний запах.
| Хімічні властивості
1. Утворення тіолятів, або меркаптидів: H3C–CH2–SH + NaOH → H3C–CH2–S–Na + H2O 2. Реакція окислення (слабкі окиснювачі): 2C2H5–SH + J2 → C2H5–S–S– C2H5 + 2HJ сильні окиснювачі: H3C–CH2–SH + (HNO3) → H3C–CH2–SO2–OH ___________________________________________
тіоефіри легко окиснюються: CH3–S–CH3 + [O] → CH3–(S=O)–CH3 + [O] → CH3–SO2–CH3
|
Сульфокислоти R–SO3H
| Представники
CH3SO3H – метил сульфокислота
CH2=CH–SO3H – етенсульфокислота
| Способи одержання
 1. Сульфокислоти з третинним вуглецевим атомом можуть бути одержані прямим сульфуванням алканів сульфатною кислотою: R–H + H2SO4 → R–SO3H 2. Реакція сульфохлорування алканів: RH + SO2 + Cl2 → R–SO2Cl + HCl RSO2Cl + H2O → RSO2OH + HCl 3. Окислення тіоспиртів: CH3SH + [O] → CH3–SO2OH 4. Алкілування натрій сульфату галогенопохід-ними: R–J Na–O (R–O–)2–SO 1. Сульфокислоти з третинним вуглецевим атомом можуть бути одержані прямим сульфуванням алканів сульфатною кислотою: R–H + H2SO4 → R–SO3H 2. Реакція сульфохлорування алканів: RH + SO2 + Cl2 → R–SO2Cl + HCl RSO2Cl + H2O → RSO2OH + HCl 3. Окислення тіоспиртів: CH3SH + [O] → CH3–SO2OH 4. Алкілування натрій сульфату галогенопохід-ними: R–J Na–O (R–O–)2–SO
 R–J SO2 → O O
Na–O \ /
R–S–O–Na 5. Олефіни приєднують гідросульфіти: R–CH=CH2 + NaHSO3 → R–CH(SO3Na)–CH3 R–J SO2 → O O
Na–O \ /
R–S–O–Na 5. Олефіни приєднують гідросульфіти: R–CH=CH2 + NaHSO3 → R–CH(SO3Na)–CH3
| Хімічні властивості
1. Реакція нейтралізації: R–SO3H + NaOH → R–SO3Na + H2O 2. Дія PCl5: R–SO2–OH + PCl5 → R–SO2–Cl + HCl + POCl3 3. Етерифікація сульфокислот: R–SO2–OH + NaOR' → R–SO2–OR' + NaOH 4. Аміди сульфокислот утворюються при дії аміака на сульфохлориди: R–SO2–Cl + 2NH3 → R–SO2–NH2 + NH4Cl
| | Фізичні властивості
Сульфокислоти жирного ряду безбарвні кристалічні речовини. Гігроскопічні. Нижчі представники легко розчиняються в воді.
|
Нітросполуки R–NO2
| Представники
Загальна формула R–NO2 CH3–NO2 – нітрометан
CH3–CH2–NO2 – нітроетан
CH3–CH2–CH2–NO2 – нітропропан–1
CH3–CHNO2–CH3 – нітропропан–2
CH3–CH2–CH2–CH2–NO2 – нітробутан–1
CH3–CH2–CHNO2–СН3 – нітробутан–2
C6H5NO2 – нітробензол
| Дія на організм людини більша частина нітросполук подразнює печінку. Гострі отруєнна тринітротолуолом, динітробензолом, аніліном викликають виражену патологію. Встановлено що вони викликають захворювання нирок і шлунково-кишкового тракту. Нітрометан – наркотик, який має різку судорожну дію. ГДК=30 мг/м3.
Нітробензол – при вживанні всередину або вдиханні дуже швидко розвивається отруєння. Токсичні концентрації і дози дуже малі: один ковток нітробензолу при прийомі через рот може викликати смерть.
| Способи одержання
1. В рідкій фазі: CH3–(CH2)4–CH3 + HNO3 → H2O + + CH3–(CH2)3–CHNO2–CH3
a) Ініціювання: HO–NO2 → HO* + NO2 б) Ріст ланцюга: R* + H2O → R–H + OHR* + HO–NO2 → R–NO2 + HO* в) Обрив ланцюга: HO* + OH → H2O2 NO2* + *NO2 → N2O4 R* + *NO2 → R–NO2 R* + *OH → R–OH R* + *R → R–R 2. CH3–CH2J + AgNO2 → CH3–CH2–NO2 + AgJ 3. BrCH2–(CH2)2–CH2Br + 2NaNO2 → → NO2–CH2–(CH2)2–CH2–NO2
| | Фізичні властивості
Нижчі гомологи нітроалканів – рідини з порівняно високою густиною і температурою кипіння. Вищі – кристалічні речовини.
| Хімічні властивості
1. Дія лугів: 2CH3–NO2 + KOH → NO2–CH2–CH=N–OH; NO2–CH2–CH=N–OH + KOH → [NO2CH2–COO]–K+; [NO2CH2–COO]–K+ + CH3OH → NO2–CH2–(C=O)–O–CH3 – метиловий естер нітрооцтової кислоти.
2. Дія мінеральних кислот: CH3–CH2–NO2 + H2SO4 → [CH3–(C=O)–NH–OH] → CH3–(C=O)–H + NH2OH*H2SO4 – сірчанокислий гідроксилаиін 3 Відновлення: CH3–CH2–NO2 + 6[H+] → CH3–CH2–NH2 + H2O + (Fe + HCl) 4. Конденсація з карбонільними сполуками:
Oδ– Oδ– Oδ–
// // //
а) CH3–Nδ+→O + CH3–C+–H → CH3–CH(OH)–CH2–N→O → CH3–CH=CH–NO2 + H2O
  б) NO2CH3 + CH2+=O– → NO2CH2–CH2OH NO2–CH=CH2 + H2O б) NO2CH3 + CH2+=O– → NO2CH2–CH2OH NO2–CH=CH2 + H2O
 NH2–CH2–CH2–OH + OH–
Якісна реакція на первинні нітросполуки: NH2–CH2–CH2–OH + OH–
Якісна реакція на первинні нітросполуки:
 CH3 CH3 NO2 CH3 CH3 NO2
 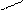  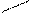 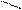 CH–NO2 + HO–NO2 → CH
CH3 CH3 NO CH–NO2 + HO–NO2 → CH
CH3 CH3 NO
|
Аміни
Аміни – продукт заміщення атомів гідрогену
в молекулі аміаку на вуглеводневі радикали
| Розрізняють аміни:
Первинні – R-NH2
Вторинні – R2-NH
Третинні – R3-N
| Дія на організм людини
Аміносполуки можуть викликати дерматити, екземи, розвиток загальної і місцевої алергії. Деякі аміни викликають пухлини сечового міхура. Концентрований розчин викликає сильні опіки і почервоніння шкіри. 2–амінонафталін – загально визначений канцероген для людини.
Анілін – викликає отрує
Ння при вдиханні парів, при попаданні рідини на шкіру. Дія підсилюється вживанням алкоголю ГДК=0,1 мг/м3.
Міри попередження: особиста гігієна. Із шкіри анілін змивають слабким розчином оцтової кислоти, потім водою з милом.
| Способи одержання
1. Відновлення нітроалканів: CH3–CH(NO2)–CH3 + 3H2 → CH3–CH(NH2)–CH3 + + 2H2O 2. Відновлення нітрилів: H3C–CH2–CN + 2H2 → H3C–(CH2)2–NH2 3. З амідів карбонових кислот: CH3–(C=O)–NH2 + Br2 + NaOH → →CH3–(C=O)–NHBr + OH– →[CH3–(C=O)–NBr]– + + H2O → (C=O)=N–CH3 + H2O + 0.5Br2→ → CH3NH2
4. Реакція Гофмана – взаємодія галогеналканів з аміаком: H3C–J + 2NH3 → [H3C–NH3]+J + NH3 → H3C–NH2 + HJ;
H3C–NH2 + H3C–J → [(H3C)2–NH2]+J (+NH3)→ → [(CH3)3–NH]+J (+NH3; –HJ)→ (H3C)3N + + (+CH3J)→ [(CH3)4N]J 5. Амінування спиртів: CH3–CH2–OH (+NH3; –H2O) → CH3–CH2–NH2 + + (+CH3–CH2–OH; –H2O) → (C2H5)2NH + + (+CH3–CH2–OH; –H2O) → (C2H5)3N
| | Фізичні властивості
Метиламін, диметиламін, триметиламін – гази, інші нижчі аміни – рідини. Нижчі газоподібні і рідкі аміни мають аміачний запах і подібно до аміаку добре розчиняються у воді. Більш складні аміни – рідини з неприємним запахом зіпсованої риби.
| | Хімічні властивості амінів
|  Приєднання протону від води і утворення гідроксидів
CH3NH2 + HOH → [CH3NH3]+OH–
Взаємодія з солями і мінеральними кислотами:
2[CH3NH3]OH + CuSO4 → [CH3NH3]2SO4 + Cu(OH)2
3[CH3NH3]OH + FeCl3 → 3[CH3NH3]Cl + Fe(OH)3
2[CH3NH3]OH + H2SO4 → [CH3NH3]2SO4 + 2H2O
(CH3)3N + HCl → [(CH3)3NH)Cl
Ацилювання амінів
C2H5–NH2 + Cl–(C=O)–CH3 → C2H5–NH–(C=O)–CH3 + HCl Приєднання протону від води і утворення гідроксидів
CH3NH2 + HOH → [CH3NH3]+OH–
Взаємодія з солями і мінеральними кислотами:
2[CH3NH3]OH + CuSO4 → [CH3NH3]2SO4 + Cu(OH)2
3[CH3NH3]OH + FeCl3 → 3[CH3NH3]Cl + Fe(OH)3
2[CH3NH3]OH + H2SO4 → [CH3NH3]2SO4 + 2H2O
(CH3)3N + HCl → [(CH3)3NH)Cl
Ацилювання амінів
C2H5–NH2 + Cl–(C=O)–CH3 → C2H5–NH–(C=O)–CH3 + HCl
| Взаємодія з азотистою кислотою: 2HNO2 ↔ O=N–O–N=O + H2O
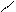  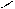  H ONO H ONO H ONO H ONO
  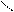  CH3–N: + N → CH3–N+–N → CH3–(NH)+=N–O– + HNO2 →
H O H O– → CH3–NH–N=O → CH3–N=N–OH → CH3–N+≡N→ N2 + CH3* (+H2O) → → CH3OH + H+; CH3* + Cl* → CH3Cl; CH3NH2 + O=N–OH → CH3OH + H2O + N2↑ CH3–N: + N → CH3–N+–N → CH3–(NH)+=N–O– + HNO2 →
H O H O– → CH3–NH–N=O → CH3–N=N–OH → CH3–N+≡N→ N2 + CH3* (+H2O) → → CH3OH + H+; CH3* + Cl* → CH3Cl; CH3NH2 + O=N–OH → CH3OH + H2O + N2↑
| | Алкілування амінів
H3Cδ+–Jδ– +:NH3 → [H3CNH3]+J– (+NH3) → NH4J + H3C–NH3 + HJ
H3CNH2 + H3Cδ+–Jδ– → [(H3C)2NH2]+J–
Взаємодія з азотистою кислотою вторинних амінів:
(C2H5)2NH + HO–N=O → (C2H5)2N–N=O + H2O
| Кислотні властивості амінів:
2CH3–NH2 + 2Na → 2CH3–NH–Na + H2↑
2(CH3)2–NH + 2Na → 2(CH3)2N–Na + H2↑
Взаємодія зі спиртами:
CH3–CH2–NH2 + CH3–CH2–OH → CH3–CH2–NH–CH2–CH3 + H2O
Етиламін диетиламін
| | | | | | |

Обзор компонентов Multisim Компоненты – это основа любой схемы, это все элементы, из которых она состоит. Multisim оперирует с двумя категориями...
|

Композиция из абстрактных геометрических фигур Данная композиция состоит из линий, штриховки, абстрактных геометрических форм...
|

Важнейшие способы обработки и анализа рядов динамики Не во всех случаях эмпирические данные рядов динамики позволяют определить тенденцию изменения явления во времени...
|

ТЕОРЕТИЧЕСКАЯ МЕХАНИКА Статика является частью теоретической механики, изучающей условия, при которых тело находится под действием заданной системы сил...
|
|
Типология суицида. Феномен суицида (самоубийство или попытка самоубийства) чаще всего связывается с представлением о психологическом кризисе личности...
ОСНОВНЫЕ ТИПЫ МОЗГА ПОЗВОНОЧНЫХ Ихтиопсидный тип мозга характерен для низших позвоночных - рыб и амфибий...
Принципы, критерии и методы оценки и аттестации персонала
Аттестация персонала является одной их важнейших функций управления персоналом...
|
|
Машины и механизмы для нарезки овощей В зависимости от назначения овощерезательные машины подразделяются на две группы: машины для нарезки сырых и вареных овощей...
Классификация и основные элементы конструкций теплового оборудования Многообразие способов тепловой обработки продуктов предопределяет широкую номенклатуру тепловых аппаратов...
Именные части речи, их общие и отличительные признаки Именные части речи в русском языке — это имя существительное, имя прилагательное, имя числительное, местоимение...
|
|









 O
Сіль адипінової кислоти Циклопентенон
O
//
O
Сіль адипінової кислоти Циклопентенон
O
//
 CH2–CH2–C–O CH2–CH2
CH2–CH2–C–O CH2–CH2
 H2C Ca → CaCO3 + CH2 C=O
CH2–CH2–C–O CH2–CH2
H2C Ca → CaCO3 + CH2 C=O
CH2–CH2–C–O CH2–CH2

 \\
O
Сіль пімелінової кислоти Циклогексанон
\\
O
Сіль пімелінової кислоти Циклогексанон
 1. Сульфокислоти з третинним вуглецевим атомом можуть бути одержані прямим сульфуванням алканів сульфатною кислотою: R–H + H2SO4 → R–SO3H 2. Реакція сульфохлорування алканів: RH + SO2 + Cl2 → R–SO2Cl + HCl RSO2Cl + H2O → RSO2OH + HCl 3. Окислення тіоспиртів: CH3SH + [O] → CH3–SO2OH 4. Алкілування натрій сульфату галогенопохід-ними: R–J Na–O (R–O–)2–SO
1. Сульфокислоти з третинним вуглецевим атомом можуть бути одержані прямим сульфуванням алканів сульфатною кислотою: R–H + H2SO4 → R–SO3H 2. Реакція сульфохлорування алканів: RH + SO2 + Cl2 → R–SO2Cl + HCl RSO2Cl + H2O → RSO2OH + HCl 3. Окислення тіоспиртів: CH3SH + [O] → CH3–SO2OH 4. Алкілування натрій сульфату галогенопохід-ними: R–J Na–O (R–O–)2–SO
 R–J SO2 → O O
Na–O \ /
R–S–O–Na 5. Олефіни приєднують гідросульфіти: R–CH=CH2 + NaHSO3 → R–CH(SO3Na)–CH3
R–J SO2 → O O
Na–O \ /
R–S–O–Na 5. Олефіни приєднують гідросульфіти: R–CH=CH2 + NaHSO3 → R–CH(SO3Na)–CH3

 б) NO2CH3 + CH2+=O– → NO2CH2–CH2OH NO2–CH=CH2 + H2O
б) NO2CH3 + CH2+=O– → NO2CH2–CH2OH NO2–CH=CH2 + H2O
 NH2–CH2–CH2–OH + OH–
Якісна реакція на первинні нітросполуки:
NH2–CH2–CH2–OH + OH–
Якісна реакція на первинні нітросполуки:
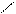 CH3 CH3 NO2
CH3 CH3 NO2


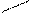
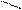 CH–NO2 + HO–NO2 → CH
CH3 CH3 NO
CH–NO2 + HO–NO2 → CH
CH3 CH3 NO
 Приєднання протону від води і утворення гідроксидів
CH3NH2 + HOH → [CH3NH3]+OH–
Взаємодія з солями і мінеральними кислотами:
2[CH3NH3]OH + CuSO4 → [CH3NH3]2SO4 + Cu(OH)2
3[CH3NH3]OH + FeCl3 → 3[CH3NH3]Cl + Fe(OH)3
2[CH3NH3]OH + H2SO4 → [CH3NH3]2SO4 + 2H2O
(CH3)3N + HCl → [(CH3)3NH)Cl
Ацилювання амінів
C2H5–NH2 + Cl–(C=O)–CH3 → C2H5–NH–(C=O)–CH3 + HCl
Приєднання протону від води і утворення гідроксидів
CH3NH2 + HOH → [CH3NH3]+OH–
Взаємодія з солями і мінеральними кислотами:
2[CH3NH3]OH + CuSO4 → [CH3NH3]2SO4 + Cu(OH)2
3[CH3NH3]OH + FeCl3 → 3[CH3NH3]Cl + Fe(OH)3
2[CH3NH3]OH + H2SO4 → [CH3NH3]2SO4 + 2H2O
(CH3)3N + HCl → [(CH3)3NH)Cl
Ацилювання амінів
C2H5–NH2 + Cl–(C=O)–CH3 → C2H5–NH–(C=O)–CH3 + HCl
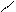

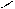
 H ONO H ONO
H ONO H ONO


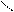
 CH3–N: + N → CH3–N+–N → CH3–(NH)+=N–O– + HNO2 →
H O H O– → CH3–NH–N=O → CH3–N=N–OH → CH3–N+≡N→ N2 + CH3* (+H2O) → → CH3OH + H+; CH3* + Cl* → CH3Cl; CH3NH2 + O=N–OH → CH3OH + H2O + N2↑
CH3–N: + N → CH3–N+–N → CH3–(NH)+=N–O– + HNO2 →
H O H O– → CH3–NH–N=O → CH3–N=N–OH → CH3–N+≡N→ N2 + CH3* (+H2O) → → CH3OH + H+; CH3* + Cl* → CH3Cl; CH3NH2 + O=N–OH → CH3OH + H2O + N2↑



