Масса и раз меры молекул. Количество вещества.Класс Урок №31 Основные положения молекулярно-кинетической теории. Масса и раз меры молекул. Количество вещества. Ребята, сегодня мы приступаем к изучению нового раздела физики – «Молекулярная физика и термодинамика». Это раздел, который изучает свойства тел с точки зрения их молекулярного строения. Изучать этот раздел мы будем на протяжении 14 модулей. За время изучения этого раздела мы напишем 2 лаборатоные работы, 1 контрольную и вам будет выставлено 2 тематических оценивания.
Изучение нового материала Из материала физики 7 класса вам известно, что все тела состоят из вещества, которое состоит из молекул. Вся «Молекулярная физика» опирается на три положения молекулярно-кинетической теории (МКТ): 1 – все вещества состоят из мельчайших частиц – молекул и атомов; 2 – молекулы и атомы находятся в беспрерывном и хаотическом движении; 3 – молекулы и атомы взаимодействуют между собой силами притяжения и отталкивания. Размеры молекул и атомов чрезвычайно малы. Приведём несколько интересных фактов: - молекула меньше яблока во столько раз, во сколько раз яблоко меньше Земли;
- если представить, что масло создает на поверхности воды пленку толщиной в одну молекулу, то такая пленка будет тоньше человеческого волоса приблизительно в 40 000 раз;
- в 1 см2 воздуха столько молекул, что взяв такое же количество песчинок, можно было бы засыпать территорию большого предприятия;
- если взять такое количество кирпичей, сколько молекул содержится в 1 см3 воздуха, то кирпич бы плотно укрыл поверхность Земли слоем высотой 120 м (высота 40-этажного дома);
- в капле воды диаметром 0,1 мм приблизительно 10
Соответственно чрезвычайно малы и массы атомов и молекул, потому для решения задач по молекулярной физике вместо собственно масс атомов и молекул используют их относительные величины, сравнивая массу атома и молекулы с 1/12 массы углерода ( Относительная молекулярная масса Мr - отношение массы молекулы к 1/12 части массы углерода: М r = m M / 1/12 m c где m M - масса молекула вещества, m c - масса атома углерода. Относительная атомная масса Аr - это отношение массы молекулы к 1/12 части атома углерода. Из-за маленькой массы молекул и атомов их массы часто измеряют не в единицах СИ - килограммах, а в атомных единицах массы (а.е.м.) - массы 1/12 части углерода. 1 а.е.м. = 1/12 m c = 1,66 Количество вещества наиболее естественно было бы измерять числом атомов или молекул в теле. Но их число в макроскопическом теле настолько большое, что в расчётах используется не абсолютное, а относительное число молекул. В СИ количество вещества выражают в молях. Молем называется количество вещества, которое содержит столько же молекул (атомов), сколько их содержится в 12 граммах углерода. Молярная масса М равна отношению массы вещества m к количеству молей М = m / где Физический смысл молярной массы: молярная масса - это масса одного моля вещества. Единица измерения молярной массы в СИ - килограмм на моль (кг/моль) М = Мr Объем одного моля вещества: VM = M /
Итальянский физик и химик Амадео Авогадро в ХІХ ст. определил количество молекул в одном моле вещества. Это количество назвали постоянной Авогадро: N A = 6,02 Число Авогадро показывает, что в одном моле любого вещества содержится 6,02 Введя понятие постоянной Авогадро, запишем ещё одну формулу для расчёта количества вещества:
и молярной массы: М = m0 NA Также Авогадро установил закон, который назвали законом Авогадро. Закон Авогадро: в равных объемах разных газов при одинаковых условиях всегда содержится одинаковое количество молекул. Согласно данному закону 1 моль газа занимает при нормальных условиях (р
Домашнее задание Выучить параграф 39 и 40; записать письменно в тетради опытное подтверждение каждого из трёх положений МКТ.
|

 молекул, что почти в миллион раз больше, чем людей, которые живут на Земле.
молекул, что почти в миллион раз больше, чем людей, которые живут на Земле. С – углерод). Такое сравнение было принято в 1961 году по предложению Д. Дальтона. Подобный выбор обусловлен тем, что углерод входит в состав многих химических соединений. А множитель 1/12 введён для того, чтобы относительные атомные массы приближались к целым числам.
С – углерод). Такое сравнение было принято в 1961 году по предложению Д. Дальтона. Подобный выбор обусловлен тем, что углерод входит в состав многих химических соединений. А множитель 1/12 введён для того, чтобы относительные атомные массы приближались к целым числам. 10
10  кг.
кг. в ней (или количеству вещества):
в ней (или количеству вещества):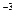 (кг/моль).
(кг/моль).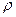 где
где 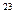 1/моль.
1/моль.
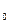 = 101 000 Па, Т= 273 К) объем 22,4
= 101 000 Па, Т= 273 К) объем 22,4  .
.


