Выводы по обзору литературы1. Изучение литературных данных свидетельствует о большом разнообразии методов анализа кислоты аскорбиновой. 2. Наиболее часто используемыми, для количественного определения кислоты аскорбиновой остаются различные титриметрические, спектрофотометрические, фотометрические и хроматографические методы. Глава 2. Методы анализа кислоты аскорбиновой в растворе для инъекций и их валидация (экспериментальная часть). Любая аналитическая методика должна быть утверждена в установленном порядке, что подтверждает ее метрологическая аттестация. Для этой цели в фармацевтической практике используют метод валидации, то есть экспериментальное доказательство того, что методика пригодна для выполнения поставленных задач. Валидации подлежат методики количественного определения, в том числе методики определения примесей. Методики проверки подлинности подвергаются валидации при необходимости подтвердить их специфичность. При валидации проводится оценка аналитической методики по перечисленным ниже характеристикам, выбираемым с учетом рекомендаций табл.: – специфичности (specificity); – пределу обнаружения или чувствительности (detectionlimit); – пределу количественного определения (quantitationlimit); – аналитической области (range); – линейности (linearity); – правильности (trueness); – прецизионности (precision); –устойчивости (robustness).
1. Валидационная оценка методик качественного и количественного анализа кислоты аскорбиновой в растворе для инъекций по показателю «Специфичность» Под специфичностью методики следует понимать способность достоверно определять анализируемое соединение в присутствии других компонентов образца – лекарственных веществ, вспомогательных веществ и посторонних примесей (включая потенциально возможные). Приготовили согласно прописи три модельных смеси (табл. 1) Таблица 1. Приготовление модельных растворов кислоты аскорбиновой
1.1.Установление специфичности в тестах «Испытание на подлинность» Для установления специфичности в идентификационных тестах, основанных на качественных реакциях, следует убедиться как в отсутствии положительного эффекта реакции на сопутствующие вещества, так и в возможности ингибирования данной реакции компонентами образца. Провели установление специфичности следующих реакций: · К 1 мл каждой модельной смеси прибавляли 0,5 мл раствора серебра нитрата (для 5 % раствора); С модельными смесями 1 и 2 выпадал темно-серый осадок (кислота аскорбиновая), с модельной смесью 3 осадок не образовывался. · 0,2 мл каждой модельной смеси разбавили 10 мл воды и прибавили по каплям раствор натрия 2, 6-дихлор-фенолиндофенолята; С модельными смесями 1 и 2 синяя окраска последнего исчезала (кислота аскорбиновая), с модельными смесями окраска сохранялась. Вывод: Реакции идентификации соответствуют валидационной оценке по показателю «Специфичность» 2.2. Установление специфичности в тестах «Количественное определение» Методики, используемые для количественного определения также должны подвергаться валидационной оценке по данному критерию. При этом для всех типов методик существуют свои особенности. Титриметрические методы. Главным является то, что растворители и сопутствующие компоненты не должны вступать в реакцию с титрантом, кроме того необходимо убедиться в специфичности индикатора. При анализе конкретных объектов следует приготовить модельную смесь и провести её титрование. Поскольку, в ряде случаев, затрачивается часть титранта на взаимодействие с растворителем, проводится контрольный опыт. На основании полученных данных принимается решение о специфичности методики. Провели установление специфичности иодатометрической методики: к 1 мл каждой модельной смеси прибавили 5 мл воды, 0,15 мл 1% раствора формальдегида, 2 мл 2% раствора кислоты хлороводородной, 0,5 мл 1% раствора калия йодида, 2 мл крахмала и тировали 0,0167 моль/л раствором йодата калия до появления светло-синего окрашивания, не исчезающего в течение 30 сек. При этом установлено, что на титрование модельной смеси 1 и 2 затрачены равные количества титранта, модельная смесь 3 в данных условиях не титруется. Провели установление специфичности иодатометрической методики: к 1 К 1,0 мл каждой модельной смеси прибавляют 5 мл воды и титруют 0,05 М раствором йода до слабо-желтого окрашивания, не исчезающего в течение 30 сек. При этом установлено, что на титрование модельной смеси 1 и 2 затрачены равные количества титранта, модельная смесь 3 в данных условиях не титруется.
3. Валидационная оценка методики анализа кислоты аскорбиновой йодатометрическим методом МЕТОДИКА КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ К 1 мл препарата прибавляют 5 мл воды, 0,15 мл 1% раствора формальдегида, 2 мл 2% раствора кислоты хлороводородной, 0,5 мл 1% раствора калия йодида, 2 мл крахмала и тируют 0,0167 моль/л раствором йодата калия до появления светло-синего окрашивания, не исчезающего в течение 30 сек. 1 мл 0,0167 М раствора калия йодата соответствует 0,008824 г кислоты аскорбиновой. Расчет теоретического объема титранта проводят по формуле:
Где V – теоретический объем титранта а – навеска K – поправочный коэффициент титранта в – содержание кислоты аскорбиновой в лекарственной форме P – 1 мл раствора Расчет содержания кислоты аскорбиновой в 1 мл раствора проводили по формуле:
Где V – практический объем титранта а – навеска K – поправочный коэффициент титранта b – содержание кислоты аскорбиновой в лекарственной форме P – 1 мл лекарственной формы
3.1. Валидационная оценка методики анализа кислоты аскорбиновой в растворе йодатометрическим методом по показателю «Линейность». Линейность методики – это наличие прямой пропорциональной зависимости аналитического сигнала от концентрации или количества определяемого вещества в анализируемой пробе. Линейность выражается уравнением у = ax + b. Это уравнение называют линейной регрессией. Параметр b градуировочной функции характеризует отрезок, отсекаемый на оси ординат и соответствующий значению холостого опыта, а коэффициент a характеризует наклон градуировочной кривой и является отражением чувствительности методики. Расчет коэффициентов градуировочного графика проводили по формулам и данным таблицы 1:
Построение градуировочного графика Точную навеску кислоты аскорбиновой (5 г) помещали в мерную колбу вместимостью 100 мл, растворяли в воде, доводил водой до метки и перемешивали (раствор А). На титрование отмерили последовательно 0,50 мл; 1,0 мл; 1,5 мл; 2,0 мл; 2,5 мл раствора А (0,075 г; 0,010 г; 0,125 г; 0,150 г; 0,175 г.) и проводили определение по методике описанной для количественного определения кислоты аскорбиновой. Данные занесли в таблицу 2.
Таблица 2. Результаты титриметрического определения кислоты аскорбиновой йодатометрическим методом
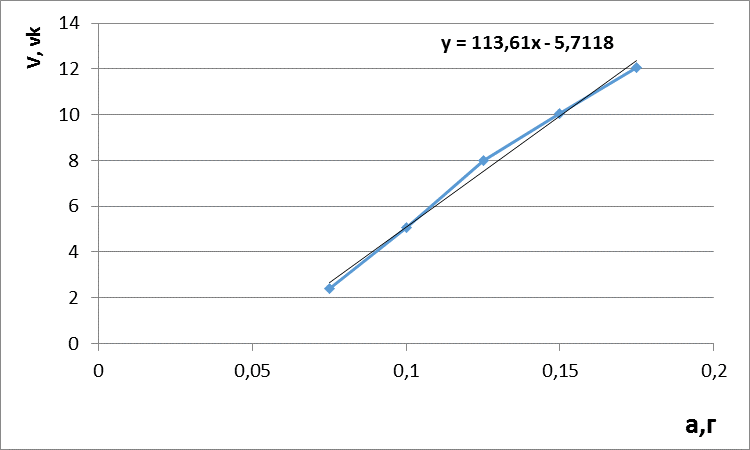
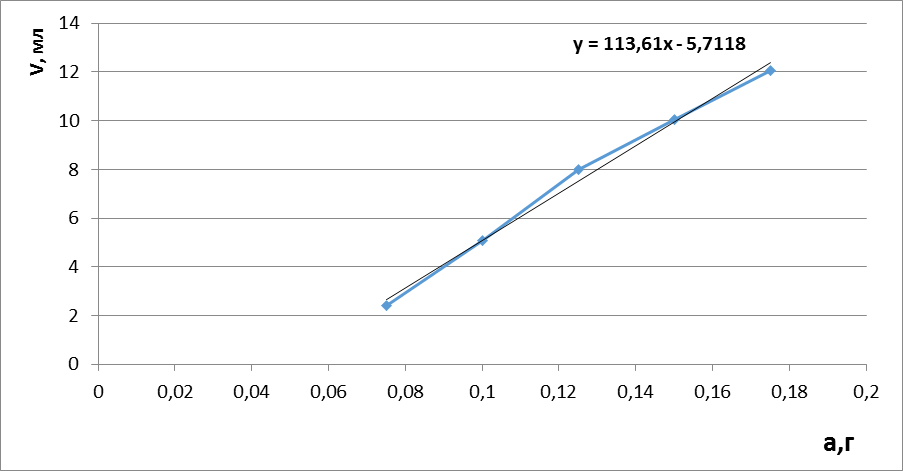
Построили градуировочный график зависимости концентраций от объема титранта, рассчитали уравнение градуировочного графика и коэффициент корреляции.
Рисунок 1 - Градуировочный график зависимости объема титранта от концентрации кислоты аскорбиновой. Основной характеристикой линейности является коэффициент корреляции — мера взаимосвязи измеренных явлений. Коэффициент корреляции (обозначается «r») рассчитывается по специальной формуле:
При математической обработке рассчитали величину коэффициента корреляции r. Коэффициент корреляции составил: r= 0,992039. Полученные результаты показали, что существует линейная зависимость между навеской кислоты аскорбиновой и объемом титранта – 0,05 М раствором йода. Как известно, для аналитических целей можно использовать только ту методику, для которой зависимость функции от аргумента коррелируется с коэффициентом r, который должен быть ≥0,99.
2.2. Валидационная оценка методики анализа кислоты аскорбиновой в растворе йодатометрическим методом по показателю «Правильность». Правильностью аналитической методики называется степень близости экспериментальных результатов к истинному значению во всей области измерений. Главным фактором, определяющим правильность, является значение систематической погрешности. Согласно рекомендациям ICH необходимо проанализировать не менее 9 образцов на 3 уровнях концентраций. Правильность методики устанавливается в указанном диапазоне ее применения. Для оценки полученных результатов наиболее простым и наглядным критерием служит открываемость (R), которая вычисляется по формуле:
При проведении анализа будут получены 9 значений открываемости. Для более детальной оценки следует статистически обработать полученные значения R, рассчитав стандартное (SD), относительное стандартное отклонение (RSD) и коэффициент Стьюдента по формуле: где m – объем выборки; SD – стандартное отклонение Для тестирования методики на правильность готовили три модельные смеси из разных навесок с точным содержанием каждого из компонентов, включая и вспомогательные вещества (таблица 3). Таблица 3. Приготовление модельных растворов кислоты аскорбиновой
Раствор А1 (модельная смесь 1) Точные навески кислоты аскорбиновой (4,0 г), трилона Б (0,02г), натрия гидрокарбоната (1,908г) и натрия сульфита (0,16 г) помещают в мерную колбу вместимостью 100 мл, растворяют в воде при нагревании на водяной бане и доводят водой до метки. Раствор А2 (модельная смесь 2) Точные навески кислоты аскорбиновой (5,0 г), трилона Б (0,025 г), натрия гидрокарбоната (2,385 г) и натрия сульфита (0,200 г) помещают в мерную колбу вместимостью 100 мл, растворяют в воде при нагревании на водяной бане и доводят водой до метки. Раствор А3 (модельная смесь 3) Точные навески кислоты аскорбиновой (6,0 г), трилона Б (0,03 г), натрия гидрокарбоната (2,862г) и натрия сульфита (0,24г) помещают в мерную колбу вместимостью 100 мл, растворяют в воде при нагревании на водяной бане и доводят водой до метки. Проводят 3 параллельных титрования на трех уровнях концентраций (9 определений) по следующей методике количественного определения: К 1 мл каждой из модельных смесей (А1, А2, А3) прибавляют 5 мл воды, 0,15 мл 1% раствора формальдегида, 2 мл 2% раствора кислоты хлороводородной, 0,5 мл 1% раствора калия йодида, 2 мл крахмала и тируют 0,0167 моль/л раствором йодата калия до появления светло-синего окрашивания, не исчезающего в течение 30 сек. 1 мл 0,0167 М раствора калия йодата соответствует 0,008824 г кислоты аскорбиновой. Расчет содержания кислоты аскорбиновой (г/мл) проводят по формуле:
где: V– объем титранта, мл; К– поправочный коэффициент; Т– титр калия йодата по определяемому веществу, г/мл; а – навеска модельной смеси, взятая на анализ, мл. Результаты занесли в таблицу №4 и рассчитали открываемость, стандартное отклонение, относительное стандартное отклонение и коэффициент Стьюдента. Таблица 4 – Результаты определения правильности методом йодатометрии
Т.о. Поскольку t =0,94 << (95%, f) =2,31, что позволяет считать результаты выборки результатов свободными от систематической ошибки.
3.2. Валидационная оценка методики анализа кислоты аскорбиновой в растворе йодатометрическим методом по показателю «Прецизионность» Приготовили модельный раствор кислоты аскорбиновой №2. Определение №1. Провели 3 параллельных титрования, отмеривая каждый раз по 0,5 мл ЛП. Определение №2. Провели 3 параллельных титрования, отмеривая каждый раз по 1,0 мл ЛП. Определение №3. Провели 3 параллельных титрования, отмеривая каждый раз по 1,5 мл ЛП. Расчет содержания кислоты аскорбиновой (г) провели по формуле приведенной при определении правильности. Результаты занесли в таблицу №5 и рассчитали стандартное отклонение (SD) и относительное стандартное отклонение (RSD).
Таблица 5. Результаты определения прецизионности кислоты аскорбиновой методом йодатометрии.
В результате проведенных исследований установлено, что RSD соответствует по показателю прецизионность.
3.Валидационная оценка методики анализа кислоты аскорбиновой йодиметрическим методом МЕТОДИКА КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ К 1,0 мл препарата прибавляют 5 мл воды и титруют 0,05 М раствором йода до слабо-желтого окрашивания, не исчезающего в течение 30 сек. 1 мл 0,05 М раствора йода соответствует 0,008824 г кислоты аскорбиновой. 3.1. Валидационная оценка методики анализа кислоты аскорбиновой в растворе иодиметрическим методом по показателю «Линейность». Построение градуировочного графика Точную навеску кислоты аскорбиновой (5 г) помещают в мерную колбу вместимостью 100 мл, растворяют в воде, доводят водой до метки и перемешивают (раствор А). На титрование отмеривают последовательно 0,50 мл; 1,0 мл; 1,5 мл; 2,0 мл; 2,5 мл раствора А (0,075 г; 0,010 г; 0,125 г; 0,150 г; 0,175 г.) и проводят определение по методике описанной для количественного определения кислоты аскорбиновой. Данные занесли в таблицу 6. Таблица 6. Результаты титриметрического определения кислоты аскорбиновой йодиметрическим методом
Построили градуировочный график зависимости концентраций от объема титранта, рассчитали уравнение градуировочного графика и коэффициент корреляции.
Рисунок 2 - Градуировочный график зависимости объема титранта от концентрации кислоты аскорбиновой. При математической обработке рассчитали величину коэффициента корреляции r. Коэффициент корреляции составил: r= 0,9966 Полученные результаты показали, что существует линейная зависимость между навеской кислоты аскорбиновой и объемом титранта – 0,05 М раствором йода. 3.2. Валидационная оценка методики анализа кислоты аскорбиновой в растворе йодиметрическим методом по показателю «Правильность». Приготовили три модельных раствора кислоты аскорбиновой (табл. 7). Таблица 7. Приготовление модельных растворов кислоты аскорбиновой
Раствор А1 (модельная смесь 1) Точные навески кислоты аскорбиновой (4,0 г), трилона Б (0,02г), натрия гидрокарбоната (1,908г) и натрия сульфита (0,16 г) помещают в мерную колбу вместимостью 100 мл, растворяют в воде при нагревании на водяной бане и доводят водой до метки. Раствор А2 (модельная смесь 2) Точные навески кислоты аскорбиновой (5,0 г), трилона Б (0,025 г), натрия гидрокарбоната (2,385 г) и натрия сульфита (0,200 г) помещают в мерную колбу вместимостью 100 мл, растворяют в воде при нагревании на водяной бане и доводят водой до метки. Раствор А3 (модельная смесь 3) Точные навески кислоты аскорбиновой (6,0 г), трилона Б (0,03 г), натрия гидрокарбоната (2,862г) и натрия сульфита (0,24 г) помещают в мерную колбу вместимостью 100 мл, растворяют в воде при нагревании на водяной бане и доводят водой до метки. Проводили 3 параллельных титрования на трех уровнях концентраций (9 определений). К 1,0 мл каждой из модельных смесей (А1, А2, А3) прибавляют 5 мл воды и титруют 0,05 М раствором йода до слабо-желтого окрашивания, не исчезающего в течение 30 сек. 1 мл 0,05 М раствора йода соответствует 0,008824 г кислоты аскорбиновой. 1 мл 0,0167 М раствора калия йодата соответствует 0,008824 г кислоты аскорбиновой. Расчет содержания кислоты аскорбиновой (г/мл) проводят по формуле:
где: V– объем титранта, мл; К– поправочный коэффициент; Т– титр йода по определяемому веществу, г/мл; а – навеска модельной смеси, взятая на анализ, мл. Р- 1 мл Результаты занесли в таблицу №8 и рассчитали открываемость, стандартное отклонение, относительное стандартное отклонение и коэффициент Стьюдента. Таблица 8 – Результаты определения правильности методом йодиметрии
Т.о. Поскольку t =0,6 << (95%, f) =2,31, что позволяет считать результаты выборки результатов свободными от систематической ошибки.
3.3. Валидационная оценка методики анализа кислоты аскорбиновой в растворе йодиметрическим методом по показателю «Прецизионность». Приготовили модельный раствор кислоты аскорбиновой №2. Определение №1. Проводят 3 параллельных титрования, отмеривая каждый раз по 0,5 мл ЛП. Определение №2. Проводят 3 параллельных титрования, отмеривая каждый раз по 1,0 мл ЛП. Определение №3. Провели 3 параллельных титрования, отмеривая каждый раз по 1,5 мл ЛП. Рассчитали содержание кислоты аскорбиновой (г/мл), стандартное отклонение (SD) и относительное стандартное отклонение (RSD). Таблица 5. Результаты определения прецизионности кислоты аскорбиновой методом йодиметрии.
В результате проведенных исследований установлено, что RSD соответствует по показателю прецизионность.
|

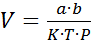 (1);
(1);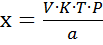 (2);
(2); (3)
(3)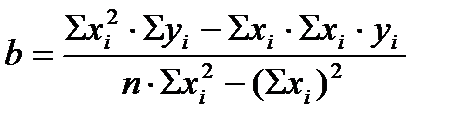 (4)
(4)
 (5)
(5)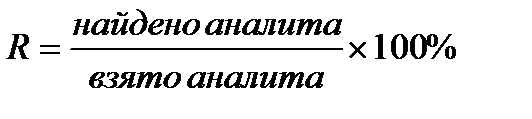
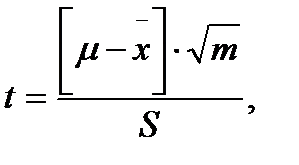
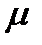 - истинное значение определяемой величины;
- истинное значение определяемой величины; - среднее значение определяемой величины;
- среднее значение определяемой величины;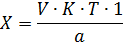
 =100,4
SD=1,913
RSD=1,27
t=0.94
=100,4
SD=1,913
RSD=1,27
t=0.94
 должно находиться в пределах от 98 до 102, следовательно, данная методикасоответствует валидационной характеристике «правильность».
должно находиться в пределах от 98 до 102, следовательно, данная методикасоответствует валидационной характеристике «правильность».

 =0.051
SD=0.01
RSD=1.68
=0.051
SD=0.01
RSD=1.68