Кремний и его соединенияП л а н 1.Положение в таблице Д.И.Менделеева, строение атома. 2. Происхождение названия. 3. Физические свойства, аллотропные модификации кремния. 4. Химические свойства. 5. Нахождение в природе. 6. Основные методы получения. 7. Важнейшие соединения кремния (кремнезем, кремниевая кислота и ее соли, силан). Кремний находится в главной подгруппе IV группы периодической системы Д.И.Менделеева, является аналогом углерода. Электронная формула кремния 1 s 22 s 22 p 63 s 2 p 2, это р -элемент. Как и углерод, кремний является неметаллом, по электроотрицательности он близок к водороду. Характерные степени окисления кремния в соединениях +4 и –4, степень окисления +4 является наиболее устойчивой: Si: 1 s 22 s 22 p 63 s 23 p 2
Si*: 1 s 22 s 22 p 63 s 13 p 3
Русское название этого элемента образовано от слова “кремень” – твердый камень для высекания огня; латинское название – silicium – происходит от слова “silex” – кремень. Ф и з и ч е с к и е с в о й с т в а Наиболее распространены две аллотропные модификации кремния – аморфный и кристаллический. Аморфный кремний – бурый тугоплавкий порошок, часто имеет желто-коричневый оттенок из-за присутствующих примесей. На воздухе покрыт прочной оксидной пленкой, устойчив, не реагирует с водой. Химически более активен, чем кристаллический кремний. Кристаллический кремний – твердое вещество темно-серого цвета со слабым металлическим блеском, обладает тепло- и электропроводностью. Кристаллический кремний очень хрупкий, непрозрачный, тугоплавкий, типичный полупроводник. Проводимость кремния возрастает при освещении и нагревании. Структура кристаллического кремния аналогична структуре алмаза, но ковалентные связи в кристалле кремния значительно слабее, чем в алмазе; это обусловливает наличие свободных электронов, обеспечивающих небольшую электропроводность. При освещении, нагревании или при наличии некоторых примесей увеличивается число разрушенных связей, соответственно увеличивается число свободных электронов и возрастают проводниковые свойства. Х и м и ч е с к и е с в о й с т в а По химическим свойствам кремний является аналогом углерода. В реакциях может проявлять как окислительные, так и восстановительные свойства. При обычных условиях довольно инертен, при комнатной температуре взаимодействует только со фтором. При нагревании химическая активность возрастает. С металлами:
c Zn, Al, Sn, Pb образует сплавы. С неметаллами: Si + O2 Si + 2Cl2 Si + 2S Si + C Si + P С Н2О: Si + 2H2O (пар) С основными оксидами: 2MgO + 3Si CuO + Si С основаниями: Si + 2NaOH + Н2О = Na2SiO3 + 2H2 Si + Cu(OH)2 С кислотами: Si + HCl Si + 6HF (конц.) = Н2[SiF6] + 2H2 Si + 4HF (г.) = SiF4 + 2H2 В отличие от углерода, кремний очень тяжело реагирует с концентрированной серной и азотной кислотами из-за образующейся на поверхности кремния пленки оксида. Поэтому на практике обычно применяют смесь концентрированной азотной и плавиковой кислот: 3Si + 4HNO3 + 12HF = 3SiF4 Н а х о ж д е н и е в п р и р о д е Кремний – один из самых распространенных элементов в земной коре (содержание – более 25 % по массе). Если углерод является основным элементом живой природы, то кремний играет такую же роль в неживой природе. В свободном виде не встречается. Среди соединений кремния распространены алюмосиликаты (соединения, содержащие оксид алюминия). Среди алюмосиликатов наибольшее распространение имеют белая глина (Al2O3•2SiO2•2H2O), полевой шпат (K2O•Al2O3•6SiO2), слюда (K2O•Al2O3•6SiO2•H2O). Многие природные силикаты в чистом виде являются драгоценными камнями (аквамарин, изумруд, топаз и др.). Также кремний встречается в природе в виде своего диоксида SiO2. В общей сложности более 50 % земной коры состоит из этого соединения. Очень чистый кристаллический оксид кремния – это горный хрусталь и кварц. Диоксид кремния, окрашенный различными примесями, образует драгоценные и полудрагоценные камни (агат, аметист, яшма и др.). М е т о д ы п о л у ч е н и я Кремний – основной материал для электроники и солнечной энергетики. И в промышленности, и в лаборатории кремний получают реакциями восстановления. В промышленности кремний восстанавливают из песка с помощью кокса: SiO2 + 2C В лаборатории в качестве восстановителя используют магний или алюминий: 3SiO2 + 4Al SiO2 + 2Mg Наиболее чистый кремний можно получить, восстанавливая тетрахлорид кремния цинком или водородом: SiCl4 + 2Zn SiCl4 + 2H2 В а ж н е й ш и е с о е д и н е н и я к р е м н и я Диоксид кремния SiO2 (кремнезем). Твердое тугоплавкое вещество белого цвета. Кислотный оксид, ангидрид кремниевой кислоты. Не реагирует с водой: SiO2 + H2O В остальном проявляет все свойства, характерные для кислотных оксидов, например: SiO2 + CaO SiO2 + 2NaOH = Na2SiO3 + H2O, SiO2 + Na2CO3 Характерна реакция взаимодействия диоксида кремния с плавиковой кислотой, которая используется при “травлении” стекла: SiO2 + 4HF = SiF4 + 2H2O. При нагревании диоксид кремния энергично взаимодействует с сильными восстановителями, например: SiO2 + 2C 3SiO2 + 4Al Кремниевая кислота H2SiO3. Очень слабая кислота (слабее угольной), в воде практически не растворима, но легко образует коллоидные растворы. При легком нагревании кремниевая кислота разлагается на оксид кремния и воду, но в обратном направлении реакция не идет: H2SiO3 Кремниевую кислоту можно получить, действуя на растворимые силикаты более сильными кислотами, эта же реакция является качественной на ион: Na2SiO3 + 2HCl = 2NaCl + H2SiO3 Из солей кремниевой кислоты растворимыми являются только силикаты натрия и калия, называемые “жидким стеклом”. Водные растворы этих солей имеют сильнощелочную реакцию среды вследствие гидролиза: Na2SiO3 + 2HOH На воздухе растворы силикатов постепенно мутнеют, т.к. находящийся в воздухе углекислый газ вытесняет кремниевую кислоту: Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3 Силан (моносилан) SiH4. Ядовитый газ с неприятным запахом плесени, легко самовоспламеняется на воздухе. SiН4 + 2О2 Получают силан гидролизом силицидов металлов, например: Ca2Si + 4H2О = 2Ca(OH)2 + SiH4 Гидролиз усиливается в присутствии кислот. В отличие от метана, силан взаимодействует с растворами щелочей, например: SiH4 + 2KOH + H2O = K2SiO3 + 4H2 При температуре выше 400 °С силан распадается на кремний и водород, но эта реакция не является обратимой: SiH4 Как и углеводороды, силаны образуют гомологический ряд: моносилан SiH4, дисилан Si2H6, трисилан Si3H8, тетрасилан Si4H10 и т.д. Полисиланы имеют общую формулу Si n H2 n +2. В свободном виде выделены силаны до Si6H14 включительно.
|

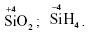
 ,
,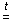 SiO2.
SiO2. нет реакции.
нет реакции.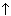 .
.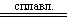 CaSiO3,
CaSiO3,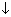 .
.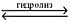 2NaOH + H2SiO3.
2NaOH + H2SiO3.


