Порядок выполнения работы. Опыт №1. Влияние концентрации тиосульфата натрия на скорость его разложения в кислой среде.
Опыт №1. Влияние концентрации тиосульфата натрия на скорость его разложения в кислой среде.
Табл. 1. Приготовление растворов.
Табл. 2. Результаты опыта.
Найдем значения скорости реакции:
1. График зависимости скорости реакции от концентрации тиосульфата натрия.
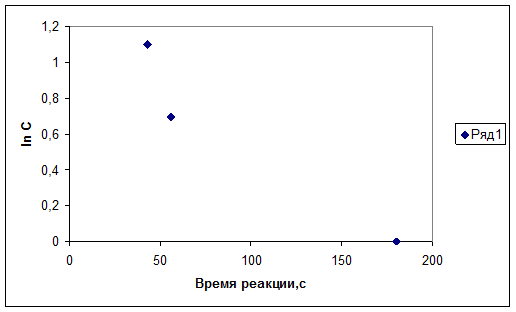
2. График зависимости логарифма относительной концентрации от времени протекания реакции.
Опыт №2. Влияние температуры на скорость реакции разложения тиосульфата натрия в кислой среде.
При обработке результатов эксперимента воспользуемся правилом Вант-Гоффа: При увеличении температуры на 10 K скорость химических реакций возрастает в 2-4 раза.
где γ – температурный коэффициент скорости реакции.
Путем проведения опыта было подтверждено эмпирическое правило Вант-Гоффа, только с незначительной погрешностью. Теперь вычислим энергию активации реакции:
где R = 8,31 Дж/моль.K, T – температура в K,
Опыт №3. Влияние концентраций реагентов на равновесие обратимой реакции между хлоридом железа (III) и тиоцианатом аммония.
FeCl3 + 3NH4CNS Налили в химический стаканчик по 5 мл 0,0025 н. растворов хлорида железа (III) и тиоцианата аммония, перемешали и разлили в 4 пробирки. I. Без добавок реакция прошла плавно и получился продукт оранжевой окраски. II. Здесь мы добавили FeCl3 (конц.), продукт окрасился в темно-оранжевый цвет; химическое равновесие сместилось вправо. III. После добавления NH4CNS (конц.) продукт окрасился в темно-красный цвет; химическое равновесие сместилось вправо. IV. Затем добавили NH4Cl, продукт окрасился в светло-бурый цвет, а химическое равновесие сместилось влево. Вывод:
Проделав данные эксперименты, мы можем сделать некоторые выводы. Из опыта №1 следует, что при увеличении концентрации тиосульфата натрия скорость его разложения в кислой среде возрастает. Эта прямо-пропорциональная зависимость отражена в графике зависимости скорости реакции от концентрации реагента. В опыте №2 мы подтвердили правило Вант-Гоффа, и выяснили, что с повышением температуры возрастает скорость химических реакций, т. к. увеличивается число активных молекул, способных к химическому взаимодействию. Эта зависимость скорости хим. реакций от температуры прямо-пропорциональная.
В опыте №3 мы убедились, что концентрация реагирующих веществ влияет на химическое равновесие следующим образом: - если увеличить концентрацию реагентов, то хим. равновесие будет смещаться вправо;
|


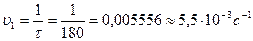



 ,
,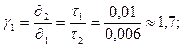


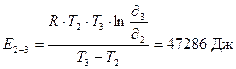
 i = скорость химической реакции.
i = скорость химической реакции. Fe(CNS)3 + 3NH4Cl
Fe(CNS)3 + 3NH4Cl


