Равновесие при кристаллизацииПоведение системы кристалл-раствор или кристалл-расплав в широком интервале температур, давлений и концентраций отображает диаграмма состояния, или фазовая диаграмма, на которой графически изображаются равновесие между различными фазами данной системы. Число степеней свободы в условиях равновесия системы устанавливается правилом фаз Гиббса:
где Число степеней свободы Фазовое равновесие однокомпонентной системы определяется двумя параметрами: температурой и давлением. В соответствии с правилом фаз число степеней свободы однокомпонентной системы при условии равновесия фаз равно единице и, следовательно, в однокомпонентной системе только один параметр может независимо изменяться без изменения числа фаз – давление или температура. На рис. 7.1 приведена диаграмма состояния для нафталина, отражающая равновесные соотношения между паром, жидкостью и твердой фазой. Область П под кривой
Рис. 7.1. Диаграмма состояния для нафталина
Точка Для двухкомпонентной системы ( На рис. 7.2 приведена фазовая диаграмма двухкомпонентной системы По фазовой диаграмме можно определить превращения в системах кристалл-раствор и кристалл-расплав. На рис. 7.3 изображена фазовая диаграмма для бинарной системы, составленной из чистых компонентов. Если охлаждать раствор с параметрами, характеризуемыми точкой А, то он достигнет состояния, характеризуемого точкой В на кривой растворимости. При этом из раствора начнет выделяться твердая фаза
Рис. 7.2. Фазовая диаграмма для двухкомпонентной системы
Рис. 7.3. Процессы фазовых превращений при охлаждении раствора (линия
Относительное количество кристаллов и раствора в этой точке определяется по «правилу рычага»:
где Можно также записать равенство:
В этом равенстве левая часть характеризует отношение массы образовавшихся кристаллов Удаление из системы А растворителя путем испарения характеризуется перемещением по горизонтали. В точке
а отношение массы кристаллов
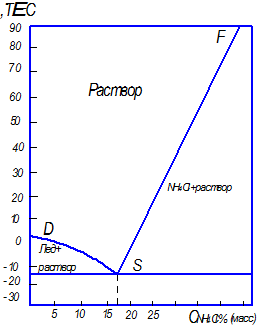
При рассмотрении процесса кристаллизации двухкомпонентных систем часто используют не полную фазовую диаграмму, а только одну из равновесных линий – кривую растворимости. При этом по оси абсцисс откладывают концентрацию, а по оси ординат – температуру (рис. 7.4).
Рис. 7.4. Рабочие линии процессов кристаллизации: изогидрической (
Кристаллизацию можно осуществить различными способами: путем охлаждения растворов, расплавов и паров (при кристаллизации из водных растворов этот способ называют изогидрической кристаллизацией); путем удаления из раствора части растворителя; высаливанием; в результате химической реакции. Наибольшее распространение в промышленности получили первые два способа, которые изображены на диаграмме растворимости (рис. 7.4). Начальное состояние исходного раствора определяется точкой А. Линия При кристаллизации высаливанием пересыщение в растворе может создаваться путем добавления в систему какого-либо вещества, снижающего растворимость основного вещества в растворителе. Добавляемое вещество называют высаливателем. В качестве примера можно привести процесс кристаллизации хлороксида циркония. В результате химической реакции получают раствор хлороксида циркония в воде. К полученному раствору добавляют соляную кислоту, при этом растворимость хлороксида циркония снижается, и он выпадает из раствора в виде кристаллов. Иногда в результате химической реакции исходный раствор становится пересыщенным по отношению к продукту реакции. Примером может служить процесс извлечения аммиака из коксовых газов путем перевода его в сульфат аммония в результате взаимодействия коксовых газов с серной кислотой. При этом сульфат аммония выпадает в виде кристаллов. Этот способ называют кристаллизацией в результате химической реакции.
|

 ,
,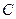 – число степей свободы системы;
– число степей свободы системы;  ,
,  – число компонентов и фаз, образующих систему.
– число компонентов и фаз, образующих систему. соответствует парообразному нафталину. Область, ограниченная кривой
соответствует парообразному нафталину. Область, ограниченная кривой  , соответствует области, в которой жидкая фаза стабильна. Область, ограниченная кривой
, соответствует области, в которой жидкая фаза стабильна. Область, ограниченная кривой  , соответствует области давлений и температур, при которых твердая фаза стабильна.
, соответствует области давлений и температур, при которых твердая фаза стабильна.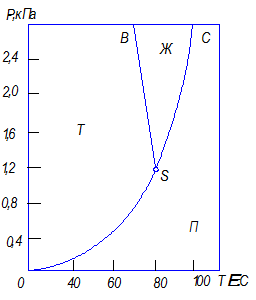
 (тройная точка) соответствует давлению и температуре, при которых в равновесии находятся три фазы: жидкая, твердая и газообразная. В соответствии с правилом фаз в этом случае
(тройная точка) соответствует давлению и температуре, при которых в равновесии находятся три фазы: жидкая, твердая и газообразная. В соответствии с правилом фаз в этом случае  0, и изменение параметров приводит к исчезновению одной или двух фаз.
0, и изменение параметров приводит к исчезновению одной или двух фаз. 2), каким обычно является солевой раствор, число степеней свободы или число независимых параметров, характеризующих эту систему, являются температура, давление и концентрация. При кристаллизации из растворов основной интерес представляют жидкая и твердая фазы данной системы. Поскольку давление незначительно влияет на равновесие между жидкой и твердой фазами, фазовые превращения целесообразнее всего представлять на диаграмме температура-концентрация.
2), каким обычно является солевой раствор, число степеней свободы или число независимых параметров, характеризующих эту систему, являются температура, давление и концентрация. При кристаллизации из растворов основной интерес представляют жидкая и твердая фазы данной системы. Поскольку давление незначительно влияет на равновесие между жидкой и твердой фазами, фазовые превращения целесообразнее всего представлять на диаграмме температура-концентрация. . Линия
. Линия  на диаграмме является геометрическим местом точек, соответствующих насыщенным растворам. Линия
на диаграмме является геометрическим местом точек, соответствующих насыщенным растворам. Линия  соответствует равновесию с твердой фазой (льдом). Таким образом, линия
соответствует равновесию с твердой фазой (льдом). Таким образом, линия  в воде, а линия
в воде, а линия  в виде кристаллов. При дальнейшем охлаждении (точка С) твердая фаза
в виде кристаллов. При дальнейшем охлаждении (точка С) твердая фаза  .
.


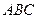 ) и при удалении растворителя (линия
) и при удалении растворителя (линия 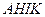 )
)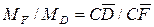 ,
,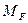 и
и  – массы кристаллов и насыщенного раствора состава
– массы кристаллов и насыщенного раствора состава 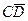 и
и 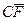 – отрезки на фазовой диаграмме.
– отрезки на фазовой диаграмме. .
.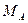 взятого исходного раствора А.
взятого исходного раствора А.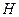 появляется равновесная твердая фаза
появляется равновесная твердая фаза  отношение массы кристаллов
отношение массы кристаллов  к массе
к массе 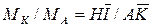 ,
, к массе
к массе  оставшегося насыщенного раствора состава
оставшегося насыщенного раствора состава 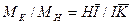 .
.
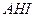 )
)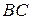 , во втором –
, во втором –  .
.


