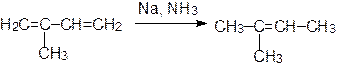РЕАКЦИЙ 3 страница2). Природа растворителя. Скорость реакции EN1 элиминирования тем выше, чем полярнее растворитель, в котором ведут реакцию. Если в ходе реакции элиминирования возможно образование более одного алкена в результате отщепления различных протонов от карбкатиона, то согласно правилу Зайцева, предпочтительнее идет образование более замещенного, т.е. термодинамически наиболее устойчивого алкена. В приведенном ниже примере, в соответствии с элиминированием по Зайцеву, образование алкена (а) более предпочтительно, чем алкена (б):
7.2. Реакции бимолекулярного отщепления (EN2)
В этих реакциях связи С-Х и С-Н разрываются одновременно в согласованном одноступенчатом процессе. Реакции протекают по схеме:
В стадии, определяющей скорость реакции, участвуют две молекулы, а кинетическое уравнение имеет вид: W = K×[CRX]×[Y], т.е. EN2-реакции имеют второй кинетический порядок. Исследования показали, что в большинстве случаев происходит анти-элиминирование Н и Х, т.е. они отщепляются, как это видно из приведенной выше схемы, с «противоположных сторон». Алкилгалогениды, в которых возможно отщепление различных b-протонов, могут привести к образованию более одного алкена:
Наиболее вероятный ход реакции элиминирования – это ее протекание в соответствии с правилом Зайцева: преобладающим будет образование того алкена, который имеет наибольшее число алкильных заместителей у атомов углерода, образующих двойную связь, т.е. продукта (б) в вышеприведенной схеме. Реакционная способность алкилгалогенидов в реакциях бимолекулярного элиминирования изменяется в той же последовательности, что и в реакциях мономолекулярного элиминирования, т.е. падает в ряду: третичный > вторичный > первичный. Этот ряд отражает относительную устойчивость образующихся в ходе реакции алкенов. Одним из факторов, влияющим на скорость реакции EN2, является сила используемого основания Y: с увеличением силы основания скорость реакции растет. Реакции нуклеофильного отщепления в большинстве случаев конкурируют с реакциями нуклеофильного замещения. Какая из них будет преобладать, зависит от условий проведения реакции и структуры реагирующих соединений. Например, при высоких температурах преимущественно протекает реакция отщепления. Вероятность элиминирования растет и при переходе от первичных алкилгалогенидов ко вторичным и к третичным. Вероятность замещения в указанном ряду падает. Первичные алкилгалогениды вступают в реакции элиминирования труднее других галогенидов, а в реакции замещения легче всех. Третичные алкилгалогениды, наоборот, подвергаются элиминированию легче, а замещению труднее.
8. Реакции окисления
Окислителями являются соединения, обладающие высоким сродством к электронам, т. е. электрофилы. В органическом синтезе чаще всего в качестве окислителей используют следующие электрофильные реагенты: кислород, пероксид водорода, пероксиды металлов, пероксикислоты, неорганические кислоты (азотная, хлорноватистая, иодная, хромовая), соединения металлов высших степеней окисления (Fe+3, KMnO4, OsO4, MnO2) и др. Для органических соединений окисление идет с присоединением атома кислорода или с отщеплением атома водорода.
8.1. Окисление алифатических углеводородов
Сравнение реакционной способности алифатических углеводородов показывает, что легкость их окисления падает в ряду: Алкены > алкины > алканы.
8.1.1. Окисление алкенов
При окислении алкенов может раскрываться p-связь или одновременно p- и s-связи, при этом образуются связи углерода с кислородом. В зависимости от строения алкена, условий проведения реакции возможно образование различных кислородсодержащих соединений: 1,2-диолов, эпоксисоединений, альдегидов, кетонов, карбоновых кислот:
1,2-диолы эпоксиды альдегиды кетоны карбоновые кислоты
Реакция Вагнера
В условиях мягкого окисления, например, действия KMnO4 на холоду в нейтральной и щелочной среде, p-связь алкенов разрывается и к двум освобождающимся валентностям присоединяются две гидроксильные группы, образуя двухатомные спирты – гликоли (1,2-диолы):
этилен этиленгликоль
Аналогично окисляются разнообразные этиленовые соединения, в том числе циклоолефины, терпены, сахара и др. При окислении диенов с изолированными двойными связями образуются дигликоли. Эта реакция применяется для обнаружения углерод-углеродной двойной связи, т. е. является качественной реакцией на непредельность (проба Байера). Реакция окисления сопровождается исчезновением фиолетовой окраски раствора KMnO4 и появлением бурого осадка MnO2:
алкен фиолетовая бурый окраска цвет
Вместо KMnO4 в качестве окислителя, приводящего к образованию 1,2-диолов, можно использовать OsO4 или пероксимуравьиную кислоту (НСОООН).
Реакция Прилежаева
алкен пероксибензойная эпоксид бензойная кислота кислота
Алкильные заместители при двойной связи значительно облегчают реакцию окисления.
Образование кетонов, кислот
В условиях энергичного окисления алкенов, например, под действием KМnO4 в кислой среде происходит разрыв p- и s- углерод-углеродных связей. В зависимости от строения исходного алкена могут образоваться кетоны, карбоновые кислоты, диоксид углерода. Примеры общих схем реакций окисления в зависимости от строения алкена:
альдегид формальдегид карбоновая не выделяются кислота
2. кетон
3.
aльдегид карбоновая не выделяется кислота
4. кетон альдегид карбоновая не выделяется кислота
5.
кетон кетон
Озонолиз
При действии озона на олефины по месту двойной связи присоединяются три атома кислорода, образуя гетероциклическое соединение, называемое мольозонидом. Мольозонид – соединение неустойчивое, самопроизвольно перегруппировывается в озонид. В присутствии воды озониды расщепляются, образуя, в зависимости от строения исходного алкена, альдегиды или кетоны. Схема реакции:
Реакция озонирования часто применяется для изучения строения олефинов, поскольку идентификация продуктов озонолиза позволяет судить о месте нахождения в их молекуле двойной связи.
8.1.2. Окисление алкинов
Алкины-1 вступают в реакцию окислительной конденсации с образованием диацетиленов.
8.1.3. Окисление алканов
Алканы относятся к наименее реакционноспособным соединениям. В частности, они не способны окисляться на холоду такими сильными окислителями, как перманганат калия и хромовая кислота. Окисление алканов при высоких температурах в избытке кислорода приводит к их полному сгоранию и образованию диоксида углерода и воды:
C3H8 + 5O2 ® 3CO2 + 4H2O пропан
При неполном сгорании образуется оксид углерода (СО). Горение – это одна из главных реакций алканов, используемых на практике как источник тепла и энергии. Окисление при невысоких температурах кислородом в присутствии катализатора – солей марганца – приводит к разрыву углеродной цепи алканов и образованию смеси предельных карбоновых кислот и гидроксикислот. При более высоких температурах в присутствии инициаторов (например, NO) алканы можно окислить в смесь кислородсодержащих продуктов (альдегидов, кетонов, кислот). Из метана в этих условиях получают формальдегид:
метан формальдегид
н-бутан уксусная кислота
Окисление алканов протекает по радикально-цепному механизму. Кислород недостаточно реакционноспособен, чтобы оторвать атом водорода алкана и образовать алкильный радикал. Поэтому используют инициатор, который выполняет эту функцию. Возникающий в присутствии инициатора алкильный радикал взаимодействует с кислородом, образуя пероксирадикал по схеме:
инициатор
Образовавшийся пероксирадикал может оторвать атом водорода от другой молекулы алкана, образуя при этом алкилгидропероксид и радикал:
Органические пероксиды, будучи очень реакционноспособными соединениями, легко разрывают связь между атомами кислорода гомолитически. Если образующиеся свободные радикалы отрывают протон от присутствующих в системе водородсодержащих частиц, то образуются спирты. В случае распада по b-связи образуются альдегиды и кетоны. Последующее окисление спиртов и альдегидов приводит к образованию кислот. Схемы распада гидропероксидов:
Механизм окисления бутана до уксусной кислоты может быть представлен следующей схемой:
Окисление парафинов кислородом в присутствии катализаторов открывает широкие возможности синтеза высших спиртов, альдегидов и карбоновых кислот, которые, в свою очередь, могут быть использованы для синтезов различных органических соединений.
8.2. Окисление спиртов
Первичные спирты окисляются в альдегиды, которые можно затем окислить до карбоновых кислот. Обычно реагенты, которые могут быть использованы для окисления первичных спиртов до альдегидов, пригодны и для окисления последних до карбоновых кислот. Чаще всего с этой целью используют перманганат калия в щелочной среде:
первичный альдегид карбоновая спирт кислота
Вторичные спирты при окислении дают кетоны:
вторичный кетон спирт
В отличие от первичных и вторичных спиртов, третичные спирты устойчивы к окислению в нейтральной и щелочной среде. В кислой среде третичные спирты окисляются с разрывом углеродной цепи у атома углерода, несущего гидроксильную группу. Причем, в этих условиях окисления в результате реакции дегидратации промежуточно образуется алкен, который затем окисляется с разрывом углеродной цепи по схеме:
Двухатомный спирт – этиленгликоль – при окислении образует гликолевый альдегид и этандиаль:
Окисление трехатомного спирта – глицерина – приводит к образованию смеси альдегида и кетона:
глицерин глицериновый диоксиацетон альдегид
При использовании тетраацетата свинца или периодата натрия для окисления спиртов, содержащих гидроксильные группы у соседних атомов углерода, происходит окислительное расщепление по схемам:
реакция не идет
Указанные реакции с расщеплением углерод-углеродной связи важны при определении структуры, поскольку на основании данных о природе и количестве образовавшихся продуктов реакции и по количеству израсходованной йодной кислоты можно получить сведения о строении исходного соединения.
8.3. Окисление оксосоединений
Альдегиды и кетоны отличаются по своему отношению к окислителям. Для альдегидов характерно окисление даже слабыми окислителями, такими как оксиды или гидроксиды металлов, которые окисляют альдегиды до соответствующих карбоновых кислот. Примерами реакций окисления альдегидов могут служить реакция "серебряного зеркала" (1), когда в качестве окислителя используют аммиачный раствор оксида серебра [Ag(NH3)2]OH (реактив Толленса), а также окисление фелинговой жидкостью (2), которую получают смешением раствора сульфата меди с щелочным раствором соли винной кислоты (сегнетовой соли):
В первой реакции комплексный ион металла восстанавливается до металлического серебра и выделяется на стенках пробирки в виде зеркального слоя (эта реакция называется реакцией "серебряного зеркала"). Во второй реакции медь восстанавливается до одновалентного состояния и выпадает красный осадок оксида меди. При окислении ненасыщенных альдегидов реактивом Толленса этот реагент не затрагивает кратную связь и приводит к образованию ненасыщенных кислот:
a,b-ненасыщенный альдегид a,b-ненасыщенная кислота
Кетоны окисляются лишь сильными окислителями при нагревании, например, горячей азотной кислотой. Окисление происходит с разрывом углеродной цепи по обе стороны карбонильной группы и, в общем случае, по правилу Попова образуется смесь четырех кислот:
Метилкетоны (,) достаточно легко окисляются под действием хлоратов, броматов, иодатов щелочных металлов, образуя галоформы:
иодоформ бутанон
Эту реакцию называют галоформной, ее используют для идентификации метилкетонов. Циклические кетоны при окислении образуют двухосновные кислоты. Например, окисление циклопентанона приводит к образованию глутаровой кислоты, а циклогексанона – адипиновой кислоты:
глутаровая кислота
циклогексанон адипиновая кислота
8.4. Окисление углеводов
При окислении моносахаридов в зависимости от природы используемых окислителей и условий реакции образуются продукты различной глубины окисления. В качестве окислителей используют: 1) реактив Толленса; 2) реактив Фелинга; 3) Br2; 4) HNO3; 5) HJO4. Мягкие окислители, например, бромная вода, фелингова жидкость, аммиачный раствор оксида серебра окисляют только альдегидные группы альдоз, образуя одноосновные полиоксикислоты, называемые альдоновыми или гликоновыми. D-глюкоза в этих условиях образует D-глюконовую кислоту. Реактивы Фелинга и Толленса окисляют и альдозы, и кетозы. Бромная вода окисляет только альдозы, но не кетозы. Обработка углеводов более сильным окислителем – азотной кислотой – вызывает образование двухосновных полиоксикислот, которые называются сахарными, или гликаровыми. В частности, при окислении D-глюкозы образуется D-глюкаровая кислота. Сложным путем можно получить уроновые кислоты, которые в молекулах содержат три функциональные группы (карбоксильную, карбонильную и гидроксильную). Окисление D-глюкозы ведет к образованию распространенной в растительном и животном мире D-глюкуроновой кислоты.
Подобно другим соединениям, содержащим две и более гидроксильные группы или гидроксильную и карбонильную группы у соседних атомов углерода, углеводы подвергаются под действием иодной кислоты окислительному расщеплению (см. раздел 8.2.). Эта реакция протекает количественно, поэтому по числу молей израсходованной HIO4 и характеру образовавшихся продуктов возможно установление структуры моносахаридов и их производных.
8.5. Окисление ароматических соединений 8.5.1. Окисление ароматических углеводородов
Бензол совершенно нереакционноспособен по отношению к обычным окислителям (H2O2, KMnO4). Лишь при высоких температурах в присутствии катализатора (V2O5) бензол может быть окислен в малеиновый ангидрид. В аналогичных условиях нафталин окисляется во фталевый ангидрид:
бензол малеиновый ангидрид
нафталин фталевый ангидрид
По сравнению с бензолом и нафталином антрацен окисляется легче. Его окисление дает 9,10-антрахинон:
антрацен 9,10-антрахинон
Боковая алифатическая цепь в алкилбензолах легко окисляется. Окисление происходит таким образом, что у бензольного кольца остается только карбоксильная группа. В качестве окислителя чаще используют KMnO4, реже – K2Cr2O7 или HNO3. Эта реакция используется для синтеза ароматических кислот:
При окислении алкенилбензолов в мягких условиях образуется гликоль; в более жестких условиях происходит образование карбоновой кислоты, в которой карбоксильная группа связана с бензольным кольцом:
1-фенил-1,2-этандиол стирол
бензойная кислота
Ароматические углеводороды вступают в реакцию с озоном. Продуктом озонолиза бензола является этандиаль (глиоксаль):
бензол этандиаль
толуол этандиаль пропанональ
8.5.2. Окисление пирокатехина, гидрохинона, анилина
Окисление перечисленных соединений приводит к образованию хинонов, которые находят основное применение в промышленном синтезе красителей:
пирокатехин о-бензохинон
гидрохинон
п-бензохинон анилин
9. Реакции восстановления
В зависимости от природы исходных органических соединений и от требуемой глубины восстановления в качестве восстановителей используют: водород в присутствии катализаторов, алюмогидрид лития, боргидрид натрия, гидразин, металлический натрий или его амальгаму, цинк и другие металлы в сочетании с минеральными кислотами и др.
9.1. Восстановление алкенов, алкадиенов
Гидрирование олефинов является важной реакцией синтеза алканов. Наиболее часто используют гетерогенное каталитическое гидрирование. Типичными катализаторами этого процесса являются платина, палладий, никель, родий:
алкен алкан
пропен пропан
Каталитическое гидрирование сопряженных, т.е. 1,3-диенов приводит обычно к образованию олефинов – продуктов 1,2- и 1,4-присоединения:
1,3-бутадиен 1-бутен 2-бутен (1,2-присоединение) (1,4-присоединение)
Восстановление 1,3-диенов натрием в жидком аммиаке дает продукты 1,4-присоединения:
2-метил-1,3-бутадиен 2-метил-2-бутен
9.2. Восстановление алкинов
Восстановление алкинов – это один из методов синтеза алкенов. Если тройная связь находится не на конце цепи, то возможен одновременный контроль стереохимии двойной связи. Например, дизамещенные ацетилены можно восстановить до транс-олефинов действием Na в жидком NH3 или алюмогидридом лития:
октин-2 транс-2-октен
гексин-3 транс-3-гексен
Синтез цис-олефинов можно осуществить, восстанавливая дизамещенные алкины водородом в присутствии катализатора – палладия на карбонате кальция, обработанном ацетатом свинца. Этот катализатор называется катализатором Линдлара.
цис-изомер
3-гексин цис-3-гексен
Восстановление ацетиленов можно направить в сторону образования цис-алкенов, если использовать и литийалюминийгидрид в присутствии TiCl4. Реакции, подобные рассмотренным, когда образуется преимущественно один из возможных стереоизомеров, называются стереоселективными. Гидрирование алкинов в присутствии Ni, Pt или Pd приводит к образованию алканов:
алкин алкан
9.3. Гидрирование алкил- и алкенилбензолов
Подобно тому как бензол реагирует с водородом в присутствии Ni-катализатора, превращаясь в циклогексан, алкилбензолы превращаются в алкилциклогексаны:
бензол циклогексан
толуол метилциклогексан
При гидрировании алкенилбензолов можно гидрировать каталитически и двойную углерод-углеродную связь, и бензольное кольцо. Условия гидрирования двойной связи значительно мягче, поэтому подобрав условия, можно прогидрировать боковую цепь, не затрагивая ароматического кольца:
стирол этилбензол этилциклогексан
9.4. Восстановление альдегидов и кетонов
При каталитическом гидрировании и использовании алюмогидрида лития альдегиды и кетоны восстанавливаются с образованием спиртов; альдегиды в этих условиях восстанавливаются до первичных спиртов, а кетоны – до вторичных спиртов:
ацетальдегид этанол
кротоновый альдегид н-бутиловый спирт
ацетон 2-пропанол
Карбонильную группу альдегидов и кетонов можно восстановить до метиленовой группы. Наиболее обычными методами являются восстановление по Клеменсену (восстановитель: амальгама цинка и концентрированная соляная кислота) и Кижнеру-Вольфу (восстановитель: гидразин и сильное основание):
по Кижнеру-Вольфу по Клеменсену
циклопентанон циклопентан
9.5. Восстановление углеводов
Восстановление моносахаридов приводит к образованию полиоксиалканов, которые называют глицитами. Глицит, образующийся при восстановлении D-глюкозы (в качестве восстановителя используют боргидрид натрия или проводят каталитическое гидрирование в присутствии никеля), называется глюцитом или сорбитом:
D-глюкоза D-сорбит
При восстановлении D-ксилозы получают пятиатомный спирт – ксилит:
9.6. Восстановление карбоновых кислот и их функциональных производных
Для восстановления карбоновых кислот до спиртов используют алюмогидрид лития:
|


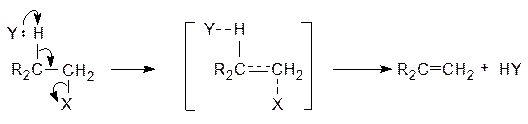


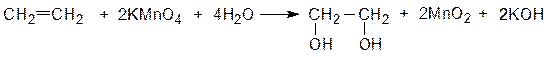
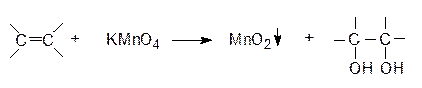
 При действии перекисных соединений (пероксида водорода, пероксибензойной, перокситрифторуксусной кислот), а также молекулярного кислорода в присутствии металлического серебра олефины способны окисляться до органических оксидов, называемых эпоксисоединениями или оксиранами. Общую схему реакции можно записать следующим образом:
При действии перекисных соединений (пероксида водорода, пероксибензойной, перокситрифторуксусной кислот), а также молекулярного кислорода в присутствии металлического серебра олефины способны окисляться до органических оксидов, называемых эпоксисоединениями или оксиранами. Общую схему реакции можно записать следующим образом: 1.
1.



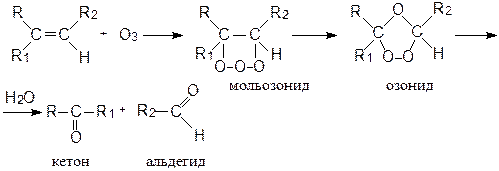
 Алкины окисляются труднее, чем алкены. Озоном, перманганатом калия дизамещенные алкины окисляются в соответствующие a-дикетоны по схеме:
Алкины окисляются труднее, чем алкены. Озоном, перманганатом калия дизамещенные алкины окисляются в соответствующие a-дикетоны по схеме:
 Промышленный интерес представляет получение уксусной кислоты окислением бутана в присутствии солей кобальта (III):
Промышленный интерес представляет получение уксусной кислоты окислением бутана в присутствии солей кобальта (III):









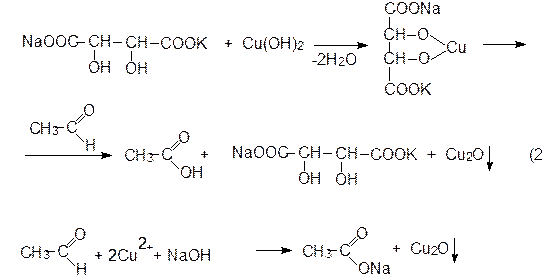










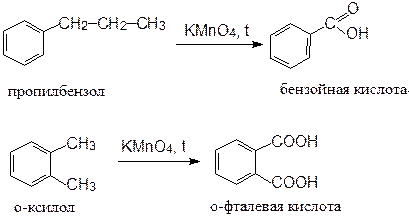


 При окислении толуола озоном образуется этандиаль и пропанональ:
При окислении толуола озоном образуется этандиаль и пропанональ: