Председатель совета А.Д.Семенов
Изучение адиабатического процесса
1. Цель работы: * Знакомство с компьютерной моделью, описывающей адиабатический процесс в идеальном газе. * Экспериментальное подтверждение закономерностей адиабатического процесса. * Экспериментальное определение показателя адиабаты, количества степеней свободы и структуры молекул газа в данной модели. 2 Оборудование и материалы: компьютерный класс, пакеты прикладных программ для поддержки лабораторного практикума компании ООО «ФИЗИКОН»: «Виртуальный практикум для ВУЗов» или «Открытая Физика» версия 2.5 часть 1. Содержание работы. 3.1 Изучить теоретический материал. 3.2 Провести испытания по изучению адиабатического процесса идеального газа для заданной температуры Т1 и заполнить таблицу аналогичную таблице 2 методических указаний. 3.3 Провести испытания по изучению адиабатического процесса идеального газа для заданной температуры Т2 и заполнить аналогичную таблице 2 методических указаний.. 3.4 Построить графики по данным таблиц. 3.5 Оформить отчет. 4 Теоретические предпосылки работы 4.1 Введение. Предмет физической химии и её разделы Изучение физической химии дает возможность понять законы химии и физики, а также предсказывать химические явления и управлять ими. Физическая химия возникла как ответвление химии, тесно связанное с физикой и широко использующее математику. Физическая химия, согласно современным представлениям, – это наука, использующая методы физики для исследования направления и скорости процессов химического превращения веществ. Термодинамический метод является одним из самых мощных методов физической химии. Он дает точные соотношения между энергией и свойствами системы, не требуя каких-либо сведений о строении молекул или механизме процессов. Термодинамика применяется к системам, находящимся в равновесии, и рассматривает только начальное и конечное состояния. Она не описывает протекания процессов во времени. Она только отвечает на вопрос: насколько глубоко должна пройти данная реакция, прежде чем будет достигнуто равновесие. Кинетика рассматривает протекание процессов во времени и связана со строением молекул и механизмом реакций. Во многих реакциях органической, неорганической и биологической химии, а также в промышленных процессах количества продуктов реакции не являются равновесными, и выходы определяются в большей степени относительными скоростями отдельных стадий, чем термодинамикой системы. Поскольку химическая кинетика основывается почти на всем материале физической химии, ее изучение отнесено в конец курса. Эколог, используя физическую химию в своей деятельности, прежде всего, должен проанализировать стоящую перед ним задачу и определить, является ли она преимущественно термодинамической или кинетической, а затем он может использовать сведения о молекулярной структуре веществ и механизме реакции для предсказания условий протекания процесса и управления ими. Кинетическая теория основывается на определенных допущениях относительно свойств молекул. Результаты кинетической теории, вытекающие из законов классической физики, оказались очень полезными, но со временем пришли в противоречие с некоторыми экспериментальными данными (например, по зависимости теплоемкости от температуры). Однако классическая кинетическая теория не потеряла своего значения для истолкования как термодинамических, так и кинетических данных. Для создания более совершенной теории необходимо использовать квантовую механику. Квантовая теория, которая революционизировала физику в начале ХХ века, необходима также для понимания химических явлений. Квантовая механика объясняет спектры атомов и молекул. Квантово-механический подход имеет большое значение в самых различных областях физической химии, например для объяснения природы химической связи. Строение молекул может быть определено из данных по дифракции рентгеновских лучей, из электронографических данных, а также по молекулярным спектрам. Сведения о строении молекул очень важны для понимания химических реакций и для расчета термодинамических свойств и реакционной способности веществ. Некоторые особенности химического поведения вещества могут быть предсказаны, если известно строение его молекул. Статистическая механика была создана для объяснения свойств веществ на основании свойств составляющих эти вещества молекул, атомов, ионов и электронов. Как термодинамические свойства веществ, так и их реакционную способность можно рассчитать с помощью статистической механики при условии, что имеются некоторые сведения о молекулах вещества, полученные спектроскопическим или иным методом. Все эти разделы физической химии основываются на экспериментальных данных, умению получать и анализировать которые способствуют самостоятельные эксперименты в процессе выполнения лабораторных работ. Основные понятия термодинамики и молекулярно-кинетической теории Простейшей моделью молекулярно-кинетической теории является модель идеального газа. В кинетической модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ. Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком диапазоне давлений и температур. Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, скорость, кинетическая энергия молекул) и макроскопическими параметрами (давление, газ, температура). В результате каждого столкновения между молекулами и молекул со стенкой скорости молекул могут изменяться по модулю и по направлению; на интервалах между последовательными столкновениями молекулы движутся равномерно и прямолинейно. В модели идеального газа предполагается, что все столкновения происходят по законам упругого удара, т.е. подчиняются законам механики Ньютона. Термодинамика – это наука о тепловых явлениях. В противоположность молекулярно-кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества, термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем. Выводы термодинамики опираются на совокупность опытных фактов и не зависят от наших знаний о внутреннем устройстве вещества, хотя в целом ряде случаев термодинамика использует молекулярно-кинетические модели для иллюстрации своих выводов. Состояние системы имеет фиксированные значения макроскопических параметров, описывающих систему в целом. Параметры, характеризующие систему в целом, называются параметрами состояния. Примерами являются температура, давление, объем и т.д. Равновесным называется такое состояние системы, при котором все параметры системы имеют определенные значения, остающееся неизменными сколь угодно долго при неизменных внешних условиях. Таким образом термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. Важным свойством термодинамически равновесной системы является выравнивание температуры всех ее частей. Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом. Если процесс протекает достаточно медленно (в пределе бесконечно медленно), то система в каждый момент времени оказывается близкой к равновесному состоянию. Процессы, состоящие из последовательности равновесных состояний, называются квазистатическими. Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема (закон Джоуля). Молекулярно-кинетическая теория приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др.), молекулы которого совершают только поступательное движение:
Поскольку потенциальная энергия взаимодействия молекул зависит от расстояния между ними, в общем случае внутренняя энергия U тела зависит наряду с температурой T также и от объема V:
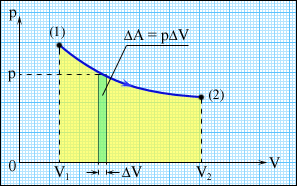
Таким образом, внутренняя энергия U тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния. Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную). Например, если газ подвергается сжатию в цилиндре под поршнем, то внешние силы совершают над газом некоторую положительную работу A'. В то же время силы давления, действующие со стороны газа на поршень, совершают работу A = – A'. Если объем газа изменился на малую величину Δ V, то газ совершает работу pS Δ x = p Δ V, где p – давление газа, S – площадь поршня, Δ x – его перемещение (рисунок 1). При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна. В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой:
или в пределе при Δ V i → 0:
Работа численно равна площади под графиком процесса на диаграмме (p, V). Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное. На рисунке 2 изображены три различных процесса, переводящих газ из состояния (1) в состояние (2). Во всех трех случаях газ совершает различную работу.
Процессы, изображенные на рисунке 2, можно провести и в обратном направлении; тогда работа A просто изменит знак на противоположный. Процессы такого рода, которые можно проводить в обоих направлениях, называются обратимыми. Равновесные процессы всегда обратимы. Круговым процессом ( циклом ) называется процесс, при котором система после ряда изменений возвращается в исходное состояние. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
Теплоемкость тела численно равна отношению количества тепла d'Q, сообщенного телу, к изменению температуры тела dT, которое при этом произошло: СТЕЛА = Удельной теплоемкостью вещества называется отношение теплоемкости к массе тела. Если тело не меняет свой объем, то оно не совершает работы, поэтому при постоянном объеме тела переданное телу тепло dQ' идет на изменение его внутренней энергии dU.
|




 . (5)
. (5)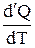 . (6)
. (6)


