Свойства простых веществСеребристо – белые, твердые, стойкие на воздухе, тугоплавкие металлы; в подгруппе сверху вниз устойчивость высшей степени окисления увеличивается. Самая устойчивая степень окисления для Mn + 4. Вследствие довольно высокой активности Mn легко окисляется при нагревании, особенно в порошкообразном состоянии, кислородом, галогенами, серой. Компактный металл на воздухе устойчив, так как покрывается оксидной пленкой, которая препятствует дальнейшему окислению металла. Еще более устойчивая пленка образуется при действии на металл холодной азотной кислоты Mn растворяется в разбавленных соляной и серной кислотах. Данная степень окисления характерна только для марганца. Он образует основной оксид переменного состава – MnO - MnO1,5, гидроксид - Mn(OH)2 . Оксид Mn (II) образуется при прокаливании карбоната марганца в атмосфере азота или водорода: MnСО3 = MnO +СО2. Так как гидроксид марганца нерастворим в воде, его получают косвенным путем: Mn2++ 2OH¯= Mn(OH)2 Он легко растворяется в кислотах, со щелочами реагирует только при сильном и длительном нагревании: Mn(OH)2+ 2H+ = Mn2+ + 2H2O Mn(OH)2 + 4OH ¯(конц.) = [Mn (ОН)6] 4 – Гидроксид в степени окисления +2 неустойчив и окисляется на воздухе, значительно легче идет окисление галогенами: Mn(ОН)2 + Br2 + 2NaOH→ MnO2 + 2 NaBr +2H2O 1 │ Mn(ОН)2 – 2ē + 2ОН ¯ → MnO2 + 2H2O 1 Br2 +2е → 2Br¯ Mn(ОН)2 + 2ОН ¯+ Br2 → MnО2 + 2H2O+2Br¯.
В зависимости от силы окислителя и рН среды ион Mn2+ может окисляться до степеней окисления +4, +6 и +7: 3MnSO4 + 2KMnO4 +3H2O = 5MnO2↓ + K2SO4 + 3H2SO4 3 │ Mn2+ – 2ē + 2H2O → MnO2 + 4H+ 2 MnO4¯ +3ē + 2H2O→ MnO2 + 4ОН ¯ 3 Mn2+ + 6H2O + 2MnO4¯ +4H2O → 3MnO2 +12H+ + 2MnO2 +8ОН ¯ tº
3 Mn2+ – 4ē + 8ОН ¯→ MnO42- + 4H2O 2 С1О3 ¯ + 6е + 3H2O → С1 ¯ + 6 ОН ¯ 3 Mn2+ + 24ОН ¯ + 2С1О3 ¯ + 6H2O →3MnO42- +4H2O+ 2С1¯+12ОН¯
2 Mn2+ – 5ē + 4H2O → MnO4- + 8H+ 5 BiO3 - + 2е + 6H+ → Bi 3+ + 3H2O 2Mn2+ + 8 H2O + 5 BiO3 - + 30 H+ → MnO4- + 16H+ + 5 Bi3+ +15H2O Последняя реакция используется в аналитической химии как качественная реакция на соединения марганца. Из комплексных соединений Mn2+ устойчивы только цианиды, осталь-ные манганаты (11) в разбавленных водных растворах распадаются. Для технеция и рения степень окисления +2 нехарактерна. Степень окисления +4: Наиболее устойчивым соединением марганца в степени окисления +4 является MnO2 черно-бурое твердое вещество, обычно переменного состава, оно широко распространено в земной коре. Кристаллы MnО2 построены по типу кристаллов рутила. При обычных температурах MnО2 в воде не растворяется и довольно инертен - без нагревания устойчив к действию большинства кислот. По химической природе оксид марганца (11) – амфотерен. При сплавлении со щелочами или основными оксидами образуются оксоманганаты (1У): MnО2 + СаО = Са MnО4. Соединения Mn(1У) сильные окислители: MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O 1 MnО2 + 2е +4H+→ Mn2+ + 2H2O 1 С1 ¯ - 2е → С12 MnО2 + 4H++ С1 ¯ → Mn2+ + 2H2O + С12 При этом аквакомплексы не образуются. При взаимодействии с горячей серной или азотной кислотой диоксид марганца разлагается с выделение кислорода. В качестве дешевого окислителя диоксид марганца широко используется в технике и лабораторной практике. При взаимодействии MnО2 с наиболее сильными окислителями проявляет восстановительные свойства, образуются производные марганца (У1) и (У11), например tº
3 MnО2– 2ē + 4ОН ¯→ MnO42- + 2H2O 1 С1О3 ¯ + 6е + 3H2O → С1 ¯ + 6 ОН ¯
2MnО2 + 3PbO2 + 6HNO3 → 2НMnO4 +3Pb(NO3)2 + 2H2O
3 PbO2 + 2е + 4H+ → Pb2+ + 2H2O 2 MnО2 + 4 H2O + 3PbO2 + 12 H+ → MnO4- +8H+ + 3Pb2+ + 6 H2O Для рения и технеция известны соединения типа ЭО2,ЭНа14, М2ЭО3. Производные Тс(1У) относительно устойчивее однотипных соединений марганца и рения. Степень окисления +6: Соединения, в которых степень окисления марганца и его аналогов равна +6, немногочисленны. Из них более устойчивы соединения рения и технеция, для которых известны оксиды, фториды, хлориды и ряд оксогало-генидов. Соли в водном растворе устойчивы только при избытке щелочи, в нейт-ральной среде они быстро диспропорционируют: 3 K2MnO4 + 2H2O = 2KMnO4 + MnO2 ↓ + 4KOH 2 MnO42- – ē → MnO4¯ 1 MnO42- + 2е + 2H2O → MnО2+ 4ОН ¯ 2MnO42- + MnO42- + 2H2O → MnO4¯ + MnО2+ 4ОН ¯ В свободном виде выделены манганаты калия и натрия - твердые вещества зеленого цвета. Еще менее устойчивы кислоты Н2ЭO4 , они разлагаются уже при получении 2 H2ЭO4 → 2HЭO4 + ЭO2 + 2H2O
Для манганатов наиболее характерны окислительные свойства, в нейтральной и слабощелочной среде они восстанавливаются до MnO2, в кислой – до Mn2+, однако в присутствии более сильного окислителя проявляют восстановительные свойства: 2K2MnO4 + Cl2 → 2KMnO4 + 2KCl. 4 К2ЭO4 + О2 + 2 Н2О→ 4КЭO4 + 4КОН.
Степень окисления + 7: 2KMnO4 (тверд.) + Н2 SO4 → Mn2O7 + К2 SO4 + Н2О. Оксидам Э(VII) соответствуют кислоты НЭO4, которые существуют в растворе. Сила кислот в растворах и их окислительная способность уменьшаются от марганцовой к реневой кислоте. Кислотам отвечают соли КЭO4, большинство из которых растворимы в воде. Термическая устойчивость солей в ряду KMnO4, К ТсО4 , КReO4 возрастает. KMnO4 легко разлагается при нагревании: 2KMnO4 → K2MnO4 + MnO2 +О2. Перманганат калия является наиболее сильным окислителем в кислой среде. В зависимости от реакции среды получаются различные продукты восстановления перманганат иона: 5Na2SO3 + 2KMnO4 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + 3H2O 2 MnO4¯+5e + 8Н+ → Mn2+ +4H2O 5 SO32- – 2ē + Н2О → SO4 2- + 2Н+ 2 MnO4¯+16Н+ +5 SO32- + 5Н2О → Mn2+ +8H2O + SO4 2- + 10Н+
3Na2SO3 + 2KMnO4 + H2O = 2MnO2↓ + 3Na2SO4 + 2KOH 2 MnO4¯+3e + 2H2O → Mn2+ +4ОН¯ 3 SO32- – 2ē + Н2О → SO4 2- + 2Н+ 2 MnO4¯+4H2O+ 3SO32- + 3Н2О → MnО2 + 8ОН¯+ 3SO4 2- + 6Н+
Na2SO3 + 2KMnO4 + 2КOН → 2K2MnO4+ Na2SO4 + H2O 2 MnO4¯+e → MnO4 2- 1 SO32- – 2ē + 2ОН ¯ → SO4 2- + H2O 2 MnO4¯+ SO32- + 2ОН¯ → 2MnO4¯ + SO4 2- + H2O Соединения рения (У11) можно перевести в более низкие степени окисления только под действием очень сильных восстановителей.
|

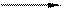 3MnSO4 + 2KС1O3 + 12KOH сплав 3 K2MnO4 +3K2SO4 + 2KCI + 6H2O
3MnSO4 + 2KС1O3 + 12KOH сплав 3 K2MnO4 +3K2SO4 + 2KCI + 6H2O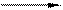 2Mn(NO3)2 + 5NaBiO3 + 16HNO3 2HMnO4+ 5Bi(NO3)3+ 5NaNO3 + 7H2O
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 2HMnO4+ 5Bi(NO3)3+ 5NaNO3 + 7H2O 3MnO2 +12ОН ¯+С1О3 +3H2O→ 3 MnO42- + 6H2O +С1 ¯+6ОН ¯
3MnO2 +12ОН ¯+С1О3 +3H2O→ 3 MnO42- + 6H2O +С1 ¯+6ОН ¯


