Строение атомаАтом – электронейтральная система, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Ядра атомов состоят из двух типов частиц (нуклонов) – протонов (р) и нейтронов (n). Заряд протона равен по величине и противоположен по знаку заряду электрона; масса его равна приблизительно одной а.е.м. Нейтрон – незаряженная частица с массой, приблизительно равной массе протона. Линейные размеры атома - ~10-8 см, ядра - ~10-12-10-13 см. Основная масса атома сосредоточена в ядре и характеризуется массовым числом А, равным сумме чисел протонов (заряда ядра) Z и нейтронов N: А=Z+N. Главной характеристикой атома является заряд ядра (Z). Он определяет число электронов, находящихся вокруг ядра, т.е. принадлежность атома к данному виду химических элементов, и соответствует атомному номеру (в периодической системе элементов – порядковому номеру) элемента. В обозначении атома элемента отражаются массовое число и количество протонов - Относительная атомная масса элемента является средней величиной массовых чисел его природных изотопов с учетом степени их распространения. Например, хлор в природе находится в основном в виде двух изотопов - Основой современной теории строения атома являются законы и положения квантовой (волновой) механики – раздела физики, изучающего движение микрообъектов. Микрообъекты обладают одновременно корпускулярными и волновыми свойствами. Для описания движения микрочастиц используется вероятностный подход, то есть определяется не их точное положение, а вероятность нахождения в той или иной области околоядерного пространства. Состояние электрона в атоме описывается с помощью квантовомеханической модели – электронного облака, плотность соответствующих участков которого пропорциональна вероятности нахождения электрона. Обычно под электронным облаком понимают область околоядерного пространства, которая охватывает примерно 90% электронного облака. Эта область пространства называется также орбиталью. Существует система квантовых чисел, которая определяет состояние электрона в атоме. Главное квантовое число n определяет энергию электрона и размер электронного облака. Оно может принимать целочисленные значения от 1 до Совокупность электронных состояний, имеющих одинаковое значение главного квантового числа n, называется электронным слоем или энергетическим уровнем. Наименьшее значение энергии Е соответствует n =1. Остальным квантовым состояниям отвечают более высокие значения энергии. Электроны, находящиеся на этих энергетических уровнях, менее прочно связаны с ядром. Для атома водорода квантовое состояние с n =1 соответствует его наименьшей энергии и называется основным. Состояния n = 2, 3, 4… называются возбужденными. Орбитальное (побочное) квантовое число Орбитальное квантовое число: 0 1 2 3 4 Подуровень: s p d f g Формы орбиталей, соответствующие различным значениям
Таким образом, энергетический подуровень – это совокупность электронных состояний, характеризующихся определенным набором квантовых чисел n и Магнитное квантовое число m l характеризует пространственную ориентацию электронного облака. Оно принимает все целочисленные значения от В общем виде любому значению l соответствует (2 l +1) значений магнитного квантового числа, то есть (2 l +1) возможных расположений электронного облака данного типа в пространстве. Следовательно, можно говорить, что число значений ml указывает на число орбиталей с данным значением l. s–состоянию соответствует одна орбиталь, p–состоянию – три, d–состоянию – пять, ¦-состоянию – семь и т.д. Все орбитали, принадлежащие одному подуровню, имеют одинаковую энергию и называются вырожденными. Общее число орбиталей, из которых состоит любой энергетический уровень (слой), равно n2, а число орбиталей, составляющих подуровень, - (2 l +1). Спиновое квантовое число ms характеризует соответственно механический момент электрона, связанный с вращением его вокруг своей оси. Оно может иметь только два значения: +1/2 или -1/2. Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. Следовательно, на одной орбитали может находиться не более двух электронов, отличающихся друг от друга значениями спинового квантового числа (спинами); максимальная емкость энергетического подуровня - 2(2 l +1) электронов, а уровня - 2n2. Распределение электронов в атоме, находящихся в основном состоянии (его электронная конфигурация), определяется зарядом электрона. При этом электроны размещаются согласно принципа минимальной энергии: наиболее устойчивое состояние электрона в атоме соответствует минимально возможному значению его энергии. Конкретная реализация этого принципа может быть осуществлена на основе правила Клечковского: с ростом атомного номера элемента электроны размещаются последовательно на орбиталях, характеризуемых возрастанием суммы главного и орбитального чисел (n+l); при одинаковых значениях этой суммы раньше заполняется орбиталь с меньшим значением главного квантового числа n. Последовательность заполнения энергетических подуровней в основном соответствует следующему ряду: 1s 2s 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p и т.д. При наличии однотипных орбиталей их заполнение происходит в соответствии с правилом Хунда: в пределах энергетического подуровня электроны располагаются так, чтобы их суммарный спин был максимальным. В таблице 1.1 приведены значения квантовых чисел для различных состояний электрона, а также указано максимальное количество электронов, которое может находиться на том или ином энергетическом уровне и подуровне в атоме. Существует два способа составления схем распределения электронов в атоме: а) в виде формул электронных конфигураций, например, для 19К – 1s22s22p63s23p64s1, где показатель степени указывает число электронов на данном подуровне; б) в виде квантовых ячеек – для изображения электронной орбитали и стрелок, направление которых указывает на ориентацию спинов электронов:
Таблица 1.1 Квантовые состояния электронов, емкость энергетических уровней и подуровней
Периодичный закон, открытый Д.И. Менделеевым в 1869 г., в современной формулировке гласит: свойства химических элементов, а также формы и свойства образуемых ими соединений находятся в периодической зависимости от величины заряда ядер их атомов. Заряд ядра (число протонов) равен атомному номеру элемента, определяет число электронов в атоме и, как следствие этого, строение его электронной оболочки в основном состоянии. Графическим изображением периодического закона является таблица периодической системы элементов. Формы такого изображения различны. Принципиальный подход к построению таблиц единый – элементы располагаются в порядке возрастания заряда ядер их атомов. Физической основой структуры периодической системы элементов служит определенная последовательность формирования электронных конфигураций атомов по мере роста порядкового номера элемента Z. В зависимости от того, какой энергетический подуровень заполняется электронами последним, различают 4 типа элементов: 1. s–элементы – последним заполняется s-подуровень внешнего энергетического уровня; 2. p–элементы – p–подуровень внешнего энергетического подуровня; 3. d – элементы – d–подуровень предпоследнего энергетического уровня. 4. f–элементы – f–подуровень третьего снаружи уровня. Элементы со сходной электронной конфигурацией (заполняются однотипные подуровни) внешних энергетических уровней обладают и сходными химическими свойствами. Периодом называется последовательный ряд элементов, электронная конфигурация внешнего энергетического уровня которых изменяются от ns1 до ns2np6 (для первого периода s1 и s2). При этом номер периода совпадает со значением главного квантового числа и внешнего энергетического уровня. Каждый из периодов (исключая первый) начинается типичным металлом и заканчивается благородным газом, которому предшествует неметалл, то есть в периоде с увеличением заряда ядра атомов наблюдается постепенное изменение свойств от металлических к типично неметаллическим, что связывается с увеличением числа электронов на внешнем энергетическом уровне. Первые три периода создают s- и p- элементы. Четвертый и последующие - включают в свой состав также элементы, у которых происходит заполнение d- и f-подуровней соответствующих внутренних энергетических уровней. f-элементы объединяются в семейства, называемые лантанидами (4f-элементы) и актинидами (5f-элементы). В вертикальных колонках, называемых группами, объединены элементы, имеющие сходное электронное строение. В короткопериодном варианте таблицы всего 8 групп, каждая из которых состоит из главных и побочных подгрупп. У элементов главных подгрупп последними заполняются s- и p- подуровни внешних энергетических уровней, электронные конфигурации которых являются основным фактором, определяющим химические свойства элементов. У элементов побочных подгрупп происходит заполнение внутренних (n-1)d- и (n-2)f-подуровней при наличии на внешнем энергетическом уровне 1 – 2 электронов. Элементы-аналоги имеют одинаковое строение внешних электронных оболочек атомов при разных значениях главного квантового числа n и поэтому проявляют сходные химические свойства. Таким образом, при последовательном увеличении зарядов атомных ядер периодически повторяется конфигурация электронных оболочек и, как следствие, периодически повторяются химические свойства элементов. В этом заключается физический смысл периодического закона. Элементы главных и побочных подгрупп различаются своими химическими свойствами, однако им присуще и общее, что объединяет их в одну группу - номер группы. Он, как правило, указывает на число электронов, которое может участвовать в образовании химических связей. В этом состоит физический смысл номера группы. Таким образом, у элементов главных подгрупп валентными (то есть участвующими в образовании химических связей) являются электроны внешнего энергетического уровня, а у элементов побочных подгрупп – и электроны предпоследних уровней. Это основное различие между элементами главных и побочных подгрупп. Поскольку электронная конфигурация атомов химических элементов изменяется периодически с ростом заряда их ядер, все свойства, определяемые электронным строением, закономерно изменяется по периодам и группам периодической системы. К таким свойствам относятся прежде всего различные химические и физические характеристики элементов: атомные и ионные радиусы, сродство к электрону, степень окисления, атомный объем и др. Периодически изменяются также многие химические и физические свойства простых и сложных веществ, образованных элементами–аналогами. Атом не имеет строго определенную границу, поэтому установить его абсолютные размеры невозможно. Различают следующие радиусы атомов. Ковалентный радиус представляет собой половину межъядерного расстояния в молекулах или кристаллах соответствующих простых веществ. Металлический радиус равен половине расстояния между центрами двух соседних атомов кристаллической решетки металла. Кроме того, различают ионные радиусы катионов, которые всегда меньше атомных радиусов соответствующих элементов, и радиусы анионов, которые больше атомных радиусов. Орбитальный радиус – теоретически рассчитанное расстояние от ядра до главного максимума электронной плоскости главной орбитали. Закономерности изменения рассматриваемых параметров в системе элементов имеет периодический характер. Наиболее общие из них следующие: 1. в периодах по мере роста заряда ядер радиусы атомов уменьшаются; 2. в группах с ростом заряда ядер радиусы атомов увеличиваются, при этом в группах А такое увеличение происходит в большей степени, чем в группах В. Химическая активность элемента определяется способностью его атомов терять или приобретать электроны. Количественно это оценивается энергией ионизации Еион атомов (или потенциалом ионизации I) и его сродством к электрону Еср. Энергия ионизации – минимальная энергия, необходимая для отрыва наиболее слабосвязанного электрона от невозбужденного атома (э - элемент):
Энергия ионизации выражается в килоджоулях на моль (кДж/моль) или в электрон-вольтах на атом (эВ/ат). Наименьшее напряжение электрического поля, при котором происходит отрыв электрона, называется потенциалом ионизации I (выражается в вольтах - В). Численное значение I в вольтах равно энергии ионизации Еион. в электрон-вольтах. Отрыву первого электрона соответствует первый потенциал ионизации I1, второго – I2, и т.д. При этом I1<I2<… Потенциал ионизации является сложной функцией некоторых свойств атома: заряда ядра, радиуса атома, конфигурации внешних электронных оболочек. Способность атома образовывать отрицательно заряженные ионы характеризуется сродством к электрону, под которым понимается энергетиский эффект присоединения электрона к нейтральному атому в процессе:
Наибольшим сродством к электрону характеризуются элементы группы VIIA. У большинства металлов и благородных газов сродство к электрону невелико или даже отрицательно. Присоединение двух или большего числа электронов к атому вообще невозможно. Электроотрицательность Для практической оценки этой способности атома введена условная относительная шкала электроотрицательности (ЭО). По такой шкале наиболее электроотрицательным среди элементов, способных образовывать химические соединения, является фтор, а наименее электроотрицательным – франций. В периоде с ростом порядкового номера элемента ЭО возрастает, а в группе, как правило - убывает.
Литература: 1. Глинка Н.Л. Общая химия. – М.: Химия, 1978. – С. 15-100. 2. Шиманович И.Е., Павлович М.Л., Тикавый В.Ф., Малашко П.М. Общая химия в формулах, определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. – С. 5-14, 32-40. 3. Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. – С. 9-21. Тема 2. Химическая связь. Типы взаимодействия молекул
Рассматриваемые вопросы; 1. Природа сил химического взаимодействия. 2. Виды химических связей. 3. Характеристики и свойства связей. 4. Механизмы образования связей. 5. Типы взаимодействия молекул. 6. Водородная связь. 7. Метод ВС и метод МО.
Мельчайшей частицей вещества является молекула, образующаяся в результате взаимодействия атомов, между которыми действуют химические связи или химическая связь. Учение о химической связи составляет основу теоретической химии. Химическая связь возникает при взаимодействии двух (иногда более) атомов. Образование связи происходит с выделением энергии. Химическая связь – это взаимодействие, которое связывает отдельные атомы в молекулы, ионы, кристаллы. Химическая связь по своей природе едина: она имеет электростатическое происхождение. Но в разнообразных химических соединениях химическая связь бывает различного типа; наиболее важные типы химической связи – это ковалентная (неполярная, полярная), ионная, металлическая. Разновидностями этих типов связи являются донорно-акцепторная, водородная и др. Между атомами металлов возникает металлическая связь. Химическая связь, осуществляемая за счет образования общей, или поделенной, пары или нескольких пар электронов, называется ковалентной. В образование одной общей пары электронов каждый атом вносит по одному электрону, т.е. участвует «в равной доле» (Льюис, 1916 г.). Ниже приведены схемы образования химических связей в молекулах H2, F2, NH3 и CH4. Электроны, принадлежащие различным атомам, обозначены различными символами.
В результате образования химических связей каждый из атомов в молекуле имеет устойчивую двух- и восьмиэлектронную конфигурацию. При возникновении ковалентной связи происходит перекрывание электронных облаков атомов с образованием молекулярного электронного облака, сопровождающееся выигрышем энергии. Молекулярное электронное облако располагается между центрами обоих ядер и обладает повышенной электронной плотностью по сравнению с плотностью атомного электронного облака.
Осуществление ковалентной связи возможно лишь в случае антипараллельных спинов неспаренных электронов, принадлежащих различным атомам. При параллельных спинах электронов атомы не притягиваются, а отталкиваются: ковалентная связь не осуществляется. Метод описания химической связи, образование которой связано с общей электронной парой, называется методом валентных связей (МВС).
Основные положения МВС 1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. 2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. При написании структурных формул электронные пары, обусловливающие связь, часто изображаются черточками (вместо точек, изображающих обобществленные электроны). Важное значение имеет энергетическая характеристика химической связи. При образовании химической связи общая энергия системы (молекулы) меньше энергии составных частей (атомов), т.е. ЕAB<ЕА+ЕB. Валентность – это свойство атома химического элемента присоединять или замещать определенное число атомов другого элемента. С этой точки зрения валентность атома проще всего определять по числу атомов водорода, образующих с ним химические связи, или числом атомов водорода, замещаемых атомом этого элемента. С развитием квантовомеханических представлений об атоме валентность стали определять числом неспаренных электронов, участвующих в образовании химических связей. Кроме неспаренных электронов, валентность атома также зависит от числа пустых и полностью заполненных орбиталей валентного электронного слоя. Энергия связи – это энергия, которая выделяется при образовании молекулы из атомов. Энергию связи обычно выражают в кДж/моль (или ккал/моль). Это одна из важнейших характеристик химической связи. Более устойчива та система, которая содержит меньше энергии. Известно, например, что атомы водорода стремятся объединиться в молекулу. Это означает, что система, состоящая из молекул Н2 содержит меньше энергии, чем система, состоящая из такого же числа атомов Н, но не объединенных в молекулы.
Рис. 2.1 Зависимость потенциальной энергии Е системы из двух атомов водорода от межъядерного расстояния r: 1 - при образовании химической связи; 2 – без ее образования.
На рисунке 2.1 показана энергетическая кривая, характерная для взаимодействующих атомов водорода. Сближение атомов сопровождается выделением энергии, которое будет тем больше, чем больше перекроются электронные облака. Однако в обычных условиях, вследствие кулоновского отталкивания, невозможно достичь слияния ядер двух атомов. Значит, на каком-то расстоянии вместо притяжения атомов, будет происходить их отталкивание. Таким образом, расстояние между атомами r0, которому отвечает минимум на энергетической кривой, будет соответствовать длине химической связи (кривая 1). Если же спины электронов у взаимодействующих атомов водорода одинаковы, то будет происходить их отталкивание (кривая 2). Энергия связи для различных атомов изменяется в пределах 170–420 кДж/моль (40–100 ккал/моль). Процесс перехода электрона на более высокий энергетический подуровень или уровень (т.е. процесс возбуждения или распаривания, о котором говорилось ранее) требует затраты энергии. При образовании химической связи происходит выделение энергии. Для того, чтобы химическая связь была устойчивой, необходимо, чтобы увеличение энергии атома за счет возбуждения было меньше энергии образующейся химической связи. Иными словами, необходимо, чтобы затраты энергии на возбуждение атомов были скомпенсированы выделением энергии за счет образования связи. Химическая связь, кроме энергии связи, характеризуется длиной, кратностью и полярностью. Для молекулы, состоящей более чем из двух атомов, существенными являются величины углов между связями и полярность молекулы в целом. Кратность связи определяется количеством электронных пар, связывающих два атома. Так, в этане Н3С–СН3 связь между атомами углерода одинарная, в этилене Н2С=СН2 – двойная, в ацетилене НСºСН – тройная. С увеличением кратности связи увеличивается энергия связи: энергия связи С–С составляет 339 кДж/моль, С=С - 611 кДж/моль и CºC - 833 кДж/моль. Химическая связь между атомами обусловливается перекрыванием электронных облаков. Если перекрывание происходит вдоль линии, соединяющей ядра атомов, то такая связь называется сигма-связью (σ-связь). Она может быть образована за счет двух s-электронов, s- и p-электронов, двух px-электронов, s и d электронов (например
Химическая связь, осуществляемая одной электронной парой, называется одинарной. Одинарная связь – всегда σ-связь. Орбитали типа s могут образовывать только σ-связи. Связь двух атомов может осуществляться более чем одной парой электронов. Такая связь называется кратной. Примером образования кратной связи может служить молекула азота. В молекуле азота px-орбитали образуют одну σ-связь. При образовании связи pz-орбиталями возникают две области
Такая связь называется пи-связью (π-связь). Возникновение π-связи между двумя атомами происходит только тогда, когда они уже связаны σ-связью. Вторую π-связь в молекуле азота образуют ру-орбитали атомов. При образовании π-связей электронные облака перекрываются меньше, чем в случае σ-связей. Вследствие этого π-связи, как правило, менее прочны, чем σ-связи, образованные теми же атомными орбиталями.
р-орбитали могут образовывать как σ-, так и π-связи; в кратных связях одна из них обязательно является σ-связью: Таким образом, в молекуле азота из трех связей одна - σ-связь и две - π-связи. Длиной связи называется расстояние между ядрами связанных атомов. Длины связей в различных соединениях имеют величины десятых долей нанометра. При увеличении кратности длины связей уменьшаются: длины связей N–N, N=N и NºN равны 0,145; 0,125 и 0,109 нм (10-9 м), а длины связей C-C, C=C и CºC равны, соответственно, 0,154; 0,134 и 0,120 нм. Между разными атомами чистая ковалентная связь может проявляться, если электроотрицаельность (ЭО)1 атомов одинакова. Такие молекулы электросимметричны, т.е. «центры тяжести» положительных зарядов ядер и отрицательных зарядов электронов совпадают в одной точке, поэтому их называют неполярными.
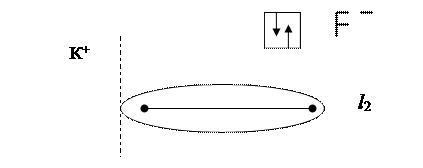
Если соединяющиеся атомы обладают различной ЭО, то электронное облако, находящееся между ними, смещается из симметричного положения ближе к атому с большей ЭО:
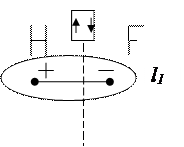
Смещение электронного облака называется поляризацией. В результате односторонней поляризации центры тяжести положительных и отрицательных зарядов в молекуле не совпадают в одной точке, между ними возникает некоторое расстояние (l). Такие молекулы называются полярными или диполями, а связь между атомами в них называется полярной. Полярная связь – разновидность ковалентной связи, претерпевшей незначительную одностороннюю поляризацию.Расстояние между «центрами тяжести» положительных и отрицательных зарядов в молекуле называется длиной диполя. Естественно, что чем больше поляризация, тем больше длина диполя и больше полярность молекул. Для оценки полярности молекул обычно пользуются постоянным дипольным моментом (Мр), представляющим собой произведение величины элементарного электрического заряда (e) на длину диполя (l), т.е. Дипольные моменты измеряют в дебаях Д (Д = 10-18 эл. ст. ед. × см, т.к. элементарный заряд равен 4,810-10 эл. ст. ед., а длина диполя в среднем равна расстоянию между двумя ядрами атомов, т.е. 10-8 см) или кулонометрах (Кл×м) (1 Д = 3,33·10-30 Кл×м) (заряд электрона 1,6·10-19 Кл умноженный на расстояние между зарядами, например, 0,1 нм, тогда Мр = 1,6·10-19×1×10-10 = 1,6·10-29 Кл · м). Постоянные дипольные моменты молекул имеют значения от нуля до 10 Д. У неполярных молекул l = 0 и Мр = 0, т.е. они не обладают дипольным моментом. У полярных молекул Мр > 0 и достигает значений 3,5 – 4,0 Д. При очень большой разности ЭО у атомов имеет место явная односторонняя поляризация: электронное облако связи максимально смещается в сторону атома с наибольшей ЭО, атомы переходят в противоположно заряженные ионы и возникает ионная молекула:
Ковалентная связь становится ионной. Электроасимметрия молекул возрастает, длина диполя увеличивается, дипольный момент возрастает до 10 Д. Суммарный дипольный момент сложной молекулы можно считать равным векторной сумме дипольных моментов отдельных связей. Дипольный момент обычно принято считать направленным от положительного конца диполя к отрицательному. Предсказать полярность связи можно с помощью относительной ЭО атомов. Чем больше разность относительных ЭО атомов, тем сильнее выражена полярность: DЭО = 0 – неполярная ковалентная связь; DЭО = 0 – 2 – полярная ковалентная связь; DЭО = 2 – ионная связь. Правильнее говорить о степени ионности связи, поскольку связи не бывают ионными на 100%. Даже в соединении CsF связь ионная только на 89%. Химическая связь, возникающая за счет перехода электронов от атома к атому, называется ионной, а соответствующие молекулы химических соединений – ионными. Для ионных соединений в твердом состоянии характерна ионная кристаллическая решетка. В расплавленном и растворенном состоянии они проводят электрический ток, обладают высокой температурой плавления и кипения и значительным дипольным моментом. Если рассматривать соединения элементов какого-либо периода с одним и тем же элементом, то по мере передвижения от начала к концу периода преимущественно ионный характер связи сменяется на ковалентный. Например, у фторидов 2-го периода LiF, BeF2, CF4, NF3, OF2, F2 степень ионности связи от фторида лития постепенно ослабевает и заменяется типично ковалентной связью в молекуле фтора. Таким образом, природа химической связи едина: принципиального различия в механизме возникновения ковалентной полярной и ионной связей нет. Эти виды связи отличаются лишь степенью поляризации электронного облака молекулы. Возникающие молекулы отличаются длинами диполей и величинами постоянных дипольных моментов. В химии значение дипольного момента очень велико. Как правило, чем больше дипольный момент, тем выше реакционная способность молекул.
Механизмы образования химической связи В методе валентных связей различают обменный и донорно-акцепторный механизмы образования химической связи. Обменный механизм. К обменному механизму образования химической связи относятся случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону. В молекулах Н2, Li2, Na2 связи образуются за счет неспаренных s-электронов атомов. В молекулах F2 и Cl2 – за счет неспаренных р-электронов. В молекулах HF и HCl связи образуются s-электронами водорода и p-электронами галогенов. Особенностью образования соединений по обменному механизму является насыщаемость, которая показывает, что атом образует не любое, а ограниченное количество связей. Их число, в частности, зависит от количества неспаренных валентных электронов. Из квантовых ячеек N и Н можно видеть, что атом азота имеет 3
неспаренных электрона, а атом водорода – один. Принцип насыщаемости указывает на то, что устойчивым соединением должен быть NH3, а не NH2, NH или NH4. Однако существуют молекулы, содержащие нечетное число электронов, например, NO, NO2, ClO2. Все они характеризуются повышенной реакционной способностью. На отдельных стадиях химических реакций могут образовываться и валентно ненасыщенные группы, которые называются радикалами, например, H, NH2, O, CH3. Реакционная способность радикалов очень высока и поэтому время их существования, как правило, мало.
|

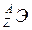 , например
, например  .
.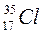 (75,43%) и
(75,43%) и  (24,57%). Относительная атомная масса хлора составляет
(24,57%). Относительная атомная масса хлора составляет  .
. .
. определяет орбитальный момент количества движения электрона и характеризует форму электронного облака. Оно принимает все целочисленные значения от 0 до (n -1). Каждому n соответствует определенное число значений
определяет орбитальный момент количества движения электрона и характеризует форму электронного облака. Оно принимает все целочисленные значения от 0 до (n -1). Каждому n соответствует определенное число значений 
 до
до 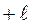 , например, при l =0 m l =0; l =1 m l = -1, 0, +1; l =2 m l = -2, -1, 0, +1, +2.
, например, при l =0 m l =0; l =1 m l = -1, 0, +1; l =2 m l = -2, -1, 0, +1, +2.

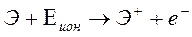 .
. .
. - условная величина, характеризующая способность атома в химическом соединении притягивать к себе электроны.
- условная величина, характеризующая способность атома в химическом соединении притягивать к себе электроны.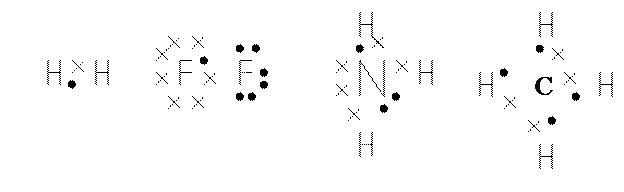



 ):
):
 перекрывания – выше и ниже оси х:
перекрывания – выше и ниже оси х: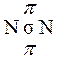 .
.
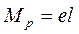 .
.