Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в системе усиливаются те процессы, которые стремятся свести это воздействие к минимуму.
Влияние концентраций реагирующих веществ на состояние равновесия При контактном способе получения Н2SO4 окисление SO2 в SO3 в присутствии катализатора (Pt или V2O5) идет по уравнению:
Если в эту равновесную систему добавить извне О2, то в системе усиливается процесс, стремящийся понизить концентрацию О2. Таким процессом является прямая реакция SO2 с О2 с образованием SO3. Таким образом, равновесие в системе сместится в сторону образования SO3. К этому же выводу можно прийти при анализе выражения для константы равновесия:
При увеличении концентрации О2 (знаменатель в этом выражении) должна возрасти концентрация SO3 (числитель). Это следует из того, что Кс=const. Таким образом, повышение концентрации O2 сдвинет равновесие к более полному использованию SO2 и к большему выходу SO3.
Влияние давления на состояние равновесия Давление имеет существенное значение при реакциях между газами. В результате увеличения давления повышается концентрация реагирующих веществ и, соответственно, скорость реакции. Рассмотрим возможные случаи. А). В реакции сумма молей исходных веществ равна сумме молей продуктов реакции. Суммарные соответствующие объемы газов тоже будут равными.
Если увеличить давление в закрытом реакционном сосуде, например, в 2 раза, то объем изменится тоже вдвое. Соответственно, вдвое изменится и концентрация газов. Скорость прямой и обратной реакций возрастает, но в равное количество раз. Поэтому смещения химического равновесия при этом не происходит.
Таким образом, если объемы исходных и конечных газообразных продуктов равновесной системы равны между собой, то изменение давления не нарушает равновесия. Б). Сумма молей исходных веществ больше суммы молей образующихся продуктов: N2 + 3H2 Û 2NH3. Из четырех молей исходных веществ образуется два моля продуктов - реакция протекает с уменьшением объема. [При повышении давления концентрация исходных веществ будет увеличиваться в большей степени, чем концентрация продуктов, что приводит к смещению равновесия в сторону образования аммиака.]
В). Сумма молей исходных веществ меньше суммы молей продуктов: N2O4 <=> 2NO2;
Прямая реакция ведет к увеличению числа молей вещества в системе, то есть к увеличению давления. При протекании обратной реакции, наоборот давление в системе падает. Если при установившемся равновесии повысить давление, то система окажет противодействие, стремясь к начальному состоянию. Равновесие будет смещаться в сторону обратной реакции, сопровождающейся понижением давления, то есть в сторону образования N2O4. Если давление снизить, то равновесие сместится в сторону прямой реакции, сопровождающейся повышением давления, то есть в сторону образования NO2. Выводы: · при изменении давления равновесие смещается только в тех обратимых реакциях, которые сопровождаются изменением объемов газообразных веществ; · повышение давления сдвигает равновесие в сторону меньших объемов, понижение – в сторону больших объемов.
|

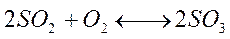 .
.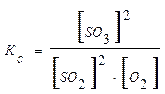 .
. .
. .
. .
.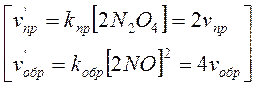 .
.


