Кинетика гомогенных каталитических реакций.Теория гомогенных химических реакций основана на следующих основных положениях: 1) исходные вещества и катализатор образуют между собой неустойчивое промежуточное соединение; 2) образование промежуточного соединения является относительно быстрым процессом; 3) промежуточное соединение находится в равновесии с исходными веществами; 4) промежуточное соединение распадается на продукты реакции и катализатор; 5) распад промежуточного соединения является относительно медленным процессом. Рассмотрим двумолекулярную химическую реакцию
А + В
В присутствии катализатора реакцию (6.8) можно записать следующим образом: А + В + К где К - катализатор; Z - промежуточное соединение исходных веществ с катализатором; k1 k2 и k3 -константы скоростей соответствующих реакций. Скорость образования промежуточного соединения в соответствии с основным постулатом химической кинетики выражается уравнением: ω1= k1CACBCK (6.10) а скорость его распада уравнением: ω2 = k2CZ (6.11) Поскольку промежуточное соединение находится в равновесии с промежуточным соединением, то ω1= ω2 (6.12) или k1CACBCK = k2CZ Если начальная концентрация катализатора составляла Со и к какому-то моменту времени концентрация промежуточного соединения стала Cz, то концентрация катализатора Ск к этому моменту времени, как видно из уравнения реакции (6.9), составит Со - Cz.. С учётом этого уравнение (13) примет вид: k1CACB(C0 – CZ) = k2CZ (14) Тогда концентрация промежуточного соединения к данному моменту времени составит: CZ = Скорость реакции (6.9) в целом определится скоростью наиболее медленной стадии распада промежуточного соединения: ω = k Таким образом, скорость гомогенной каталитической реакции пропорциональна концентрации катализатора. Если скорость реакции образования промежуточного соединения намного превышает скорость обратной реакции (k2 ω = k3C 0 (17) В этом случае скорость реакции будет зависть только от концентрации катализатора. Если скорость распада промежуточного соединения на исходные вещества намного превышает скорость реакции его образования (k2» k1), то уравнение (6.16) принимает вид:
Скорость реакции в этом случае будет пропорциональна концентрации катализатора и концентрации реагирующих веществ. В практике широкое распространение в водных растворах имеет кислотно-основной катализ, где роль катализатора играют ионы водорода и гидроксила. Это явление получает объяснение при рассмотрении кислот и оснований как веществ, способных обмениваться протонами. Здесь кислотой называется соединение, способное отдавать протоны, а основанием - соединение, способное принимать протоны. В этой модели кислота выступает как донор протонов, а основание как акцептор. Равновесие, устанавливающиеся в таких реакциях, называют кислотно - основным. В общем виде такую реакцию можно представить уравнением: К + О = К++O- (6.19) где К - исходная кислота; О - исходное основание; К+ - образующаяся кислота; О-- образующееся основание. Согласно теории гомогенного катализа каталитические реакции, в которых кислота и основание выступают как катализаторы, можно записать в виде: А + К где k1, k2 и kз - константы скоростей соответствующих реакций Роль катализатора в гомогенных каталитических реакциях сводится к изменению механизма протекания химической реакции, по сравнению с некаталитической. Катализатор переводит химическую реакцию на энергетически более выгодный путь, в результате чего энергия активации каталитической реакции меньше, чем некаталитической. Таким образом, роль катализатора в конечном итоге сводится к понижению энергии активации химической реакции.
|

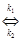 АВ
АВ  продукты + К (6.8)
продукты + К (6.8) (13)
(13)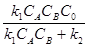 (15)
(15)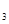 CZ =
CZ =  (16)
(16) k1), то уравнение (16) принимает вид:
k1), то уравнение (16) принимает вид: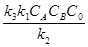 = k’CACBC0 (6.18)
= k’CACBC0 (6.18)


