Политропный процессПолитропным процессом называется любой произвольный процесс изменения состояния рабочего тела, происходящий при постоянной теплоёмкости сп. В политропном процессе dq=cп·dT. Для получения графика политропного процесса в p-v координатах будем придерживаться тех же рассуждений, что и при получении графика адиабатного процесса. Заменим в соотношениях, полученных при изучении адиабатного процесса, обозначение теплоёмкости с на сп и обнаружим, что p·vn=const, а Покажем, что адиабатный процесс делит все процессы на две группы: на процессы, в которых теплоёмкость больше нуля, и на процессы, в которых теплоёмкость меньше нуля. Так как
Из последнего выражения видно, что при n>k cп>0, а при k>n>1 cп<0. В заключение отметим, что все рассмотренные ранее процессы – это частные случаи политропного процесса. При n=k имеем адиабатный процесс. При n=0 имеем р1·v10=р2·v20, то есть изобарный процесс (p1=p2). При n=1 имеем р1·v1= р2·v2, то есть изотермический процесс. При n=∞; имеем
9 вопрос
Одно из основных – это первое начало термодинамики. Впервые было сформулировано еще в 19 веке. Фактически представляет собой закон сохранения энергии применительно к происходящим в макросистемах термодинамическим процессам. Кстати, часто именно при помощи этого постулата отрицается возможность существования вечного двигателя, так как для совершения работы необходимо извне сообщать системе дополнительную энергию. Согласно ему, в замкнутой изолированной системе значение энергии всегда остается неизменным.- Читайте подробнее на FB.ru: http://fb.ru/article/46441/pervoe-i-vtoroe-nachalo-termodinamiki Второе начало термодинамики знакомо каждому с детства. Согласно ему, тепловая энергия может естественным образом передаваться только в одном направлении – от более нагретого тела к менее нагретому. К примеру, именно поэтому зимой на улице кажется холодно, так как температура окружающей среды ниже, чем у тела человека, что и вызывает теплоотдачу. Второе начало термодинамики является одним из самых известных. Одно из его следствий говорит о том, что вся внутренняя энергия системы не может быть полностью преобразована в полезную работу. Что интересно, второе начало термодинамики математически недоказуемо. Путем постановки множества опытов была выведена данная закономерность, впоследствии принятая за аксиому.- Читайте подробнее на FB.ru: http://fb.ru/article/46441/pervoe-i-vtoroe-nachalo-termodinamiki 10 вопрос
Энтальпия Энтальпия — это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту. Часть внутренней энергии всегда остается в веществе и поддерживает его молекулярную структуру. Часть кинетической энергии вещества недоступна, когда его температура приближается к температуре окружающей среды. Следовательно, энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении. Единицы энтальпии — британская тепловая единица или джоуль для энергии и Btu/lbm или Дж/кг для удельной энергии. 12 вопрос Энтропия - процесс вырождения энергии, переход одного вида энегрии в другой. Например электрическая - в тепловую! 13 вопрос Термодинами́ческие ци́клы — круговые процессы в термодинамике, то есть такие процессы, в которых начальные и конечные параметры, определяющие состояние рабочего тела (давление, объём, температура, энтропия), совпадают. Термодинамические циклы являются моделями процессов, происходящих в реальных тепловых машинах для превращения тепла вмеханическую работу. Компонентами любой тепловой машины являются рабочее тело, нагреватель и холодильник (с помощью которых меняется состояние рабочего тела).
где C другой стороны, в соответствии с первым началом термодинамики, можно записать
Аналогичным образом, количество теплоты, переданное нагревателем рабочему телу, равно
Отсюда видно, что наиболее удобными параметрами для описания состояния рабочего тела в термодинамическом цикле служат температура и энтропия.
14 вопрос В термодинамике цикл Карно́; или процесс Карно — это обратимый круговой процесс, состоящий из двух адиабатическихи двух изотермических процессов[1]. В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником[2]. Цикл Карно назван в честь французского учёного и инженера Сади Карно, который впервые его описал в своём сочинении «О движущей силе огня и о машинах, способных развивать эту силу» в 1824 году[3][4]. Поскольку обратимые процессы могут осуществляться лишь с бесконечно малой скоростью, мощность тепловой машины в цикле Карно равна нулю. Мощность реальных тепловых машин не может быть равна нулю, поэтому реальные процессы могут приближаться к идеальному обратимому процессу Карно только с большей или меньшей степенью точности. В цикле Карно тепловая машина преобразует теплоту в работу с максимально возможным коэффициентом полезного действия из всех тепловых машин, у которых максимальная и минимальная температуры в рабочем цикле совпадают соответственно с температурами нагревателя и холодильника в цикле Карно[5].
Обратный цикл Карно[править | править вики-текст] В термодинамике холодильных установок и тепловых насосов рассматривают обратный цикл Карно, состоящий из следующих стадий[6][7]: адиабатического сжатия за счёт совершения работы (на рис. 1 — процесс В→Б); изотермического сжатия с передачей теплоты более нагретому тепловому резервуару (на рис. 1 — процесс Б→А); адиабатического расширения (на рис. 1 — процесс А→Г); изотермического расширения с отводом теплоты от более холодного теплового резервуара (на рис. 1 — процесс Г→В).
Первая и вторая теоремы Карно[править | править вики-текст] Основная статья: Теорема Карно (термодинамика) Из последнего выражения следует, что КПД тепловой машины, работающей по циклу Карно, зависит только от температур нагревателя и холодильника, но не зависит ни от устройства машины, ни от вида или свойств её рабочего тела. Этот результат составляет содержание первой теоремы Карно [8]. Кроме того, из него следует, что КПД может составлять 100 % только в том случае, если температура холодильника равна абсолютному нулю. Это невозможно, но не из-за недостижимости абсолютного нуля (этот вопрос решается только третьим началом термодинамики, учитывать которое здесь нет необходимости), а из-за того, что такой цикл или нельзя замкнуть, или он вырождается в совокупность двух совпадающих адиабат и изотерм. Поэтому максимальный КПД любой тепловой машины не может превосходить КПД тепловой машины Карно, работающей при тех же температурах нагревателя и холодильника. Это утверждение называется второй теоремой Карно[5]. Оно даёт верхний предел КПД любой тепловой машины и позволяет оценить отклонение реального КПД от максимального, то есть потери энергии вследствие неидеальности тепловых процессов.
УРАВНЕНИЕ ОБРАЩЕНИЯ ВОЗДЕЙСТВИЙ. СОПЛА И ДИФФУЗОРЫ Изменения условий течения газа, вызывающие соответствующие изменения параметров состояния потока, называются воздействиями. Существует пять видов воздействий: Течение газа описывается следующими уравнениями: . Особенность этого выражения заключается в том, что знак его левой части изменяется при переходе значения скорости через критическое (M=1), поэтому характер влияния отдельных физических воздействий на газовое течение противоположен при дозвуковом и сверхзвуковом режимах. Воздействия, вызывающие ускорение (dc > 0 в дозвуковом по токе (M < 1) — сужение капала dF<0, подвод дополнительной массы газа dG > 0, совершение газом работы dlтехн > 0, трение dqтр>0 приводят к замедлению сверхзвукового потока; воздействия обратного знака (dF > 0; dG < 0; dlтехн < 0; dlтр; dq < 0), приводят к замедлению дозвукового потока и ускорению сверхзвукового. Отсюда следует важный вывод: под влиянием одностороннего воздействия величину скорости газового потока можно довести до критической, но нельзя перевести через нее. 18 вопрос Процесс истечения газа из сопел можно рассматривать как адиабатический, т. е. происходящим без обмена теплотой с окружающей средой. Иногда это истечение газа совершается без производства внешней полезной работы (простое истечение газа), иногда же (в пульверизаторах, форсунках, пылеугольных горелках) истекающий газ производит работу раздробления жидкости на мелкие частички и сообщает уносимым частичкам скорость, равную скорости истечения газа. 19 вопрос
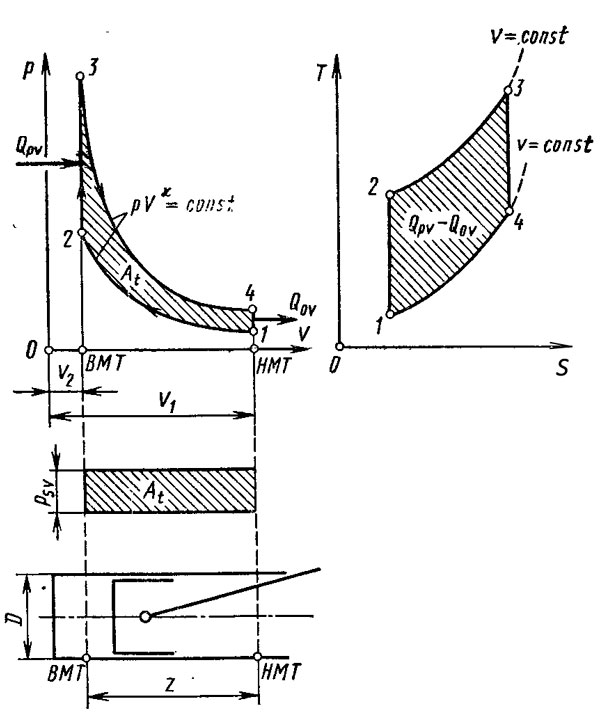
22 вопрос Циклы двигателей внутреннего сгорания В качестве первого примера рассмотрим цикл с подводом теплоты при постоянном объеме, к которому довольно близок действительный цикл работы, бензинового двигателя. Этот цикл представлен на рис. 1, где показано изменение давления p в цилиндре в зависимости от объема газа V. Для наглядности в нижней части рисунка схематически изображен цилиндр с поршнем. Диаметр цилиндра D, ход поршня Z. Пунктиром показано верхнее (ВМТ) и нижнее (НМТ) положения поршня. Объем камеры сгорания — V2, а степень сжатия ε = V1/V2.
Для определения теплового баланса необходимо знать количество подводимой Qp и отводимой Q0 теплоты. Так называемый термический коэффициент полезного действия рассчитывается по формуле η = (Qp – Q0)/Qp. Начнем наблюдать за ходом цикла на рис. 1 от точки 1, соответствующей нижнему положению (НМТ) поршня. При его движении вверх происходит адиабатическое сжатие вплоть до точки 2, соответствующей верхнему положению (ВМТ) поршня. От точки 2 до точки 3 при неподвижном поршне к газу подводится теплота QpV и давление газа растет. От точки 3 поршень передвигается к точке 4 (НМТ) и происходит адиабатическое расширение. На участке от точки 4 до точки 1 при неподвижном поршне теплота Q0V от газа отводится к стенкам цилиндра. Заштрихованная площадь индикаторной диаграммы обозначает выполненную работу At. Кроме описанной p—V-диаграммы на рис. 1 изображен тот же цикл в координатах температура Т — энтропия S. Для нашего анализа достаточно определить, что понимается под величинами энтропии S. Энтропию невозможно измерить прямым путем, поэтому условимся, что если к веществу подводится теплота, энтропия растет, а при отводе от него теплоты — уменьшается. Диаграммы в координатах Т—S будут служить лишь для сравнения с циклом Карно, представляющим максимально достижимый по эффективности цикл. Другой термодинамический цикл, у которого теплота подводится при постоянном давлении, изображен на рис. 2. Этот цикл наиболее близок к действительному циклу работы дизельного двигателя, прежде всего, при низких частотах вращения. Создав определенный закон подачи топлива, можно поддерживать максимальное давление в цилиндре при сгорании почти постоянным.
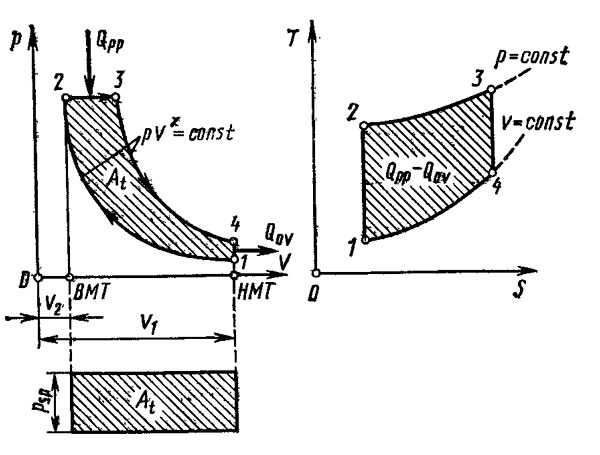
По сравнению с предыдущим рисунком диаграмма на рис. 2 отличается тем, что после завершения хода сжатия в точке 2 впрыск топлива происходит при уже начавшемся ходе расширения таким образом, чтобы давление газов при сгорании оставалось постоянным вплоть до точки 3, после которой начинается адиабатическое расширение. В действительности подвод теплоты не протекает лишь при постоянном объеме или только при постоянном давлении. К реальным условиям ближе всего цикл со смешанным подводом теплоты, изображенный на рис. 3. В этом случае подвод теплоты начинается в точке 2 после завершения сжатия, и количество теплоты QpV подводится при постоянном объеме до точки 2, 3, а дальнейшее ее поступление в количестве Qpp происходит при постоянном давлений вплоть до точки 3. После этого от точки 3 до точки 4 происходит адиабатическое расширение.
Описанные выше термодинамические циклы в действительности не выдерживаются. Для сравнения приведем еще цикл Карно (рис. 4), обеспечивающий максимальное использование подводимой теплоты. Этот цикл начинается, как и другие, с адиабатического сжатия от точки 1 до точки 2. На диаграмме T—S это адиабатическое сжатие изображено вертикальной прямой, так как энтропия при этом не изменяется, а повышается только температура от T2 до T1. В точке 2 начинается изотермический подвод теплоты, продолжающийся до точки 3. Так как температура не изменяется, то, следовательно, должен увеличиваться объем. На диаграмме T—S этот процесс изображен горизонтальной прямой при постоянной температуре T1. Энтропия газа на этом участке увеличивается. От точки 3 до точки 4 происходит адиабатическое расширение, изображенное на диаграмме T—S вертикальным отрезком 3—4. Затем следует отвод теплоты при постоянной температуре до точки 1. Работа, выполненная в этом цикле, на T—S-диаграмме показана прямоугольником 1—2—3—4 и представляет собой максимально возможное использование теплоты в диапазоне температур от T1 до T2. Однако реализовать на практике такой цикл невозможно. В двигателе внутреннего сгорания после расширения газов из цилиндра вместе с ними отводится и содержащаяся в них теплота. В цилиндр затем поступает холодный воздух из окружающей атмосферы. У четырехтактного двигателя это достигается прибавлением такта выпуска и такта впуска, а у двухтактного — продувкой цилиндра при положении поршня в НМТ. У газотурбинного двигателя сжатие и расширение газа протекает во вращающихся компрессоре и турбине. Давление газа в камере сгорания, если пренебречь потерями от завихрений, почти не меняется, так что давление на выходе компрессора практически равно давлению на входе турбины. Подробнее об этом рассказано в статье «Газотурбинный двигатель».
Двигатели внешнего сгорания Двигатель Стирлинга относится к двигателям с внешним сгоранием. Рабочее тело (воздух) получает теплоту не за счет прямого сгорания топлива в рабочем цилиндре, а путем ее подвода извне через стенки. Подробнее это рассмотрено в статье «Двигатель Стирлинга». Цикл со смешанным подводом теплоты (см. рис. 3) может служить и для оценки двигателя Стирлинга с тем исключением, что часть отводимой теплоты Q0 при использовании регенератора снова возвращается в общее количество подводимой теплоты Qp. Изменение давления в цилиндре реального двигателя существенно отличается от изменения давлений в термодинамическом цикле. Это вызвано тем, что сгорание топлива не происходит только в момент нахождения поршня в ВМТ или при постоянном давлении в начале хода расширения. Выпускные каналы открываются раньше, чем поршень достигает НМТ, и поэтому давление перед ней уже ниже того, которое было бы в НМТ поршня при закрытом канале. Сжатие также начинается лишь после закрытия впускного клапана, т. е. после НМТ. Однако для четырехтактных двигателей в представленных выше диаграммах термодинамических циклов не изображены процессы изменения давления при тактах впуска и выпуска, из-за наличия которых углы термодинамических циклов в действительных рабочих циклах значительно скруглены вблизи ВМТ и НМТ. Поскольку здесь рассматривается только один практический вопрос — снижение расхода топлива при условии обеспечения эффективного и экономичного функционирования автомобиля, выше были изложены лишь основные принципы, необходимые для понимания циклов работы двигателей. Для привода автомобиля ранее применялся паровой двигатель, о котором конструкторы не забывают и сегодня. Поэтому кратко поясним принципы работы паросиловой установки по циклу Ранкина.
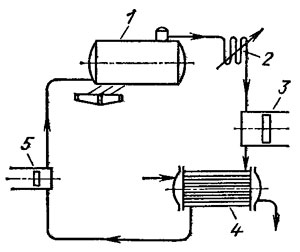
Схема такой установки изображена на рис. 5. В паровом котле 1 вода нагревается до точки кипения, а насыщенный пар поступает к пароперегревателю 2, в котором температура пара увеличивается. Перегретый пар далее поступает в паровой двигатель 3, цилиндр которого снабжен тепловой изоляцией, где происходит адиабатическое расширение пара и за счет этого совершается работа. Отработанный пар из двигателя поступает в конденсатор 4, где конденсируется в воду. Вода из конденсатора при помощи питающего насоса 5 снова возвращается в паровой котел. Полезная работа парового двигателя определяется разницей работ, совершаемых собственно паровой машиной и питающим насосом. Так как объем воды, подаваемой насосом в котел, незначителен по сравнению с объемом пара, выходящего из котла при постоянном давлении, то при низких значениях давления работа этого насоса весьма мала и ее можно не учитывать. В отличие от двигателей внутреннего сгорания, где процесс сгорания топлива происходит непосредственно в рабочем цилиндре, паровой двигатель не имеет камеры сжатия (сгорания). Это явный выигрыш, поскольку камера сжатия — вредное пространство, которое должно быть минимальным. Отрицательное свойство парового двигателя состоит в том, что теплота к рабочему телу подводится через металлическую стенку, которая должна иметь высокую термостойкость и прочность. Несмотря на то, что в настоящее время паровые котлы работают под давлением выше 10 МПа и при температуре пара 470 °C, величина температуры рабочего тела остается почти на 2000 °C меньше, чем в двигателе внутреннего сгорания. Минимальная температура T2 может быть у сравниваемых циклов одинаковой, так как это практически температура окружающего воздуха. У парового двигателя с конденсатором легко достижимо значение T2= 40 °C. У хорошей паровой турбины КПД составляет примерно 34 % в сравнении с 40 % у двигателя внутреннего сгорания. Однако при использовании паровой турбины необходимо учитывать, что КПД котла составляет примерно 85 %, так что общий КПД паровой турбины в целом падает до 28,9 %. Топливо для котла дешевле нефтяных моторных топлив, так как в качестве него может использоваться уголь. Теплотворная способность угля, правда, меньше, чем нефти, однако если в качестве котельного топлива используют природный газ или мазут, то разница в затратах по сравнению с углем невелика.
24 вопрос егенеративный цикл — цикл паротурбинной установки, в котором питательная вода до её поступления в котельный агрегат подвергается предварительному нагревупаром, отбираемым из промежуточной ступени паровой турбины. Подогрев реализуется посредством специального теплообменника - регенеративного подогревателя. Значение цикла[править | править вики-текст] Увеличение КПД при применении регенерации составляет 10-15 %. При этом экономия теплоты в цикле возрастает с повышением начального давления p1 пара. Это связано с тем что с повышением p1 увеличивается температура кипения воды, а следовательно повышается количество теплоты, которое можно подвести к воде при подогреве её отработанным паром. В настоящее время регенеративный подогрев применяется на всех крупных электростанциях.
25 вопрос Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
где p — давление; V — объем; T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m — масса; М — молярная масса; R — газовая постоянная. Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
где p — давление; V — объем; T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m — масса; М — молярная масса; R — газовая постоянная.
26 вопрос Водяной пар — газообразное состояние воды. Не имеет цвета, вкуса и запаха. Содержится в тропосфере. Образуется молекулами воды при её испарении. При поступлении водяного пара в воздух он, как и все другие газы, создаёт определённое давление, называемоепарциальным.[1] Оно выражается в единицах давления — паскалях. Водяной пар может переходить непосредственно в твёрдую фазу — в кристаллы льда. Количество водяного пара в граммах, содержащегося в 1 кубическом метре, называют абсолютной влажностью воздуха.
27 вопрос Влажный воздух представляет собой механическую смесь сухого воздуха и водяного пара. Влажный воздух называют ненасыщенным, если водяной пар находится в нем в перегретом состоянии, и насыщенным, если водяной пар в воздухе сухой насыщенный. Бывает пересыщенный влажный воздух, когда в нем кроме водяного пара присутствует капельная влага. Состояние влажного воздуха характеризуется абсолютной влажностью, относительной влажностью и влагосодержанием.
28 вопрос ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
|

 . В дальнейшем всё, что написано об адиабатном процессе, можно распространить на описание политропного процесса, заменяя в выражениях k на n.
. В дальнейшем всё, что написано об адиабатном процессе, можно распространить на описание политропного процесса, заменяя в выражениях k на n.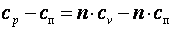 ;
;  ;
;  ;
;  .
.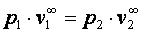 или
или  , что равносильно
, что равносильно  или
или 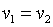 , то есть изохорный процесс.
, то есть изохорный процесс.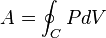 ,
,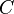 — контур цикла.
— контур цикла. .
.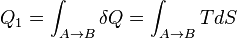 .
.



 <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;"> <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;"> <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">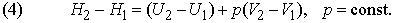 <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;"> <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;"> <="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;">
<="" div="" style="padding: 0px; margin: 0px; border-style: none; cursor: default;"> <="" div="" style="padding: 0px; margin: 0px; border-style: n
<="" div="" style="padding: 0px; margin: 0px; border-style: n


