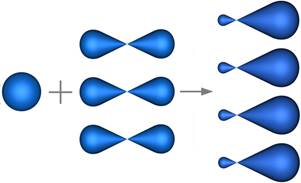
Sp 2-Гибридизацияsp 2 -Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s - и двух p -электронов (рис. 1).
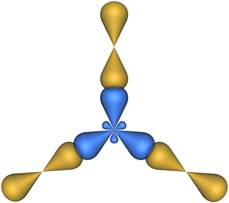
В результате гибридизации образуются три гибридные sp 2 орбитали, расположенные в одной плоскости под углом 120° друг к другу (рис. 2).
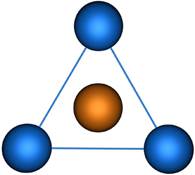
Пространственная конфигурация молекулы, центральный атом которой включает в себя sp 2-гибридные орбитали, представлена на рис. 3.
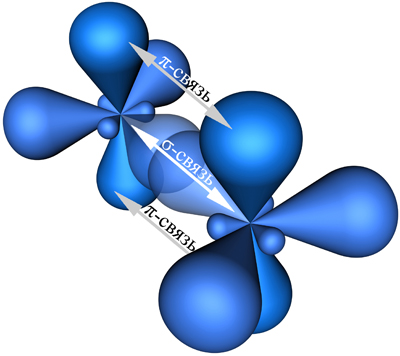
Примеры соединений, в которых наблюдается sp 2-гибридизация: SO3, BCl3, BF3, AlCl3, CO32-, NO3-. Кроме того, sp 2-гибридизация характерна для всех этиленовых углеводородов (алкенов) (общая формула CnH2n), карбоновых кислот и ароматических углеводородов (аренов) и других органических соединений: C2H4 (этилен), C4H8, C6H12, C6H6 (бензол), C8H10, C9H12, CH3COOH, C6H5OH (фенол), СH2O (формальдегид), C5H9NO4 (глутаминовая кислота) и др. Атомы углерода, находящиеся во втором валентном состоянии (sp 2-гибридизация) связаны друг с другом двойными химическими связями. При sp 2-гибридизации атом углерода образует три σ; -связи и одну π; -связь с соседними атомами углерода (рис. 5).
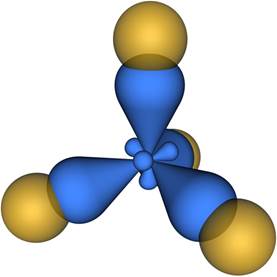
sp 3-Гибридизация sp 3- Гибридизация – гибридизация, в которой участвуют атомные орбитали одного s - и трех p -электронов (рис. 1).
Четыре sp 3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28' (рис. 2).
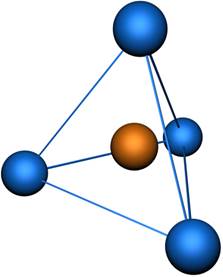
Пространственная конфигурация молекулы, центральный атом которой образован sp 3-гибридными орбиталями – тетраэдр (рис. 3).
Однако не всегда пространственная конфигурация молекулы соответствует тетраэдру, это зависит от числа атомов в молекуле. Рассмотрим подобный случай на примере молекул воды и аммиака. NH3. Валентность атома азота – III, его пять электронов внешнего уровня занимают четыре орбитали, значит, тип гибридизации – sp 3, но только три орбитали принимают участие в образовании химической связи. Тетраэдр без одной вершины превращается в пирамиду. Поэтому у молекулы аммиака форма молекулы пирамидальная, угол связи искажается до 107°30′. Аналогичные рассуждения о строении молекулы воды (H2O) приводят нас к тому, что кислород находится в sp 3 гибридном состоянии, а форма молекулы - угловая, угол связи составляет 104°27′. На рис. 4 представлена модель молекулы метана (CH4), в которой атом углерода подвергается sp 3-гибридизации.
Примеры соединений, для которых характерна sp 3-гибридизация: H2O, NH3, POCl3, SO2F2, SOBr2, NH4+, H3O+. Также, sp 3-гибридизация наблюдается во всех предельных углеводородах (алканы, циклоалканы) и других органческих соединениях: CH4, C5H12, C6H14, C8H18 и др. Общая формула алканов: CnH2n+2. Общая формула циклоалканов: CnH2n. В предельных углеводородах все химические связи одинарные, поэтому между гибридными орбиталями этих соединений возможно только σ; -перекрывание.
|