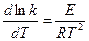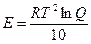Факторы, влияющие на скорость ферментативных реакций.Влияние концентрации субстрата на скорость ферментативной реакции. Концентрация субстрата является важнейшим фактором, определяющим скорость ферментативной реакции. Еще в 1902 г. В. Анри при изучении реакции ферментативного гидролиза сахарозы предположил, что фермент β-фруктофуранозидаза взаимодействует со своим субстратом, затем это соединение (фермент-субстратный комплекс) распадается, фермент остается в первоначальном виде, а субстрат сахароза оказывается расщепленной на глюкозу и фруктозу (слайд 4). Это положение об образовании промежуточного соединения фермент-субстрат было в дальнейшем развито Л. Михаэлисом и его сотрудницей М. Ментен. Уравнение Михаэлиса-Ментен основано на предположении, что одна молекула субстрата реагирует с одной молекулой фермента. В 1913 г. они постулировали следующие уравнения ферментативной реакции (слайд 5):
где к +1 — константа скорости реакции образования комплекса ЕS, к- 1 к+2 — константы скорости реакции распада комплекса ЕS в двух направлениях, т.е. КS — константа диссоциации комплекса ЕS равна отношению констант скоростей обратной и прямой реакции (слайд 6):
Если константа диссоциации комплекса фермент-субстрат КS велика, то велика значение к- 1 и мало значение к+1. отсюда следует, что комплекс очень легко распадается на исходные вещества и реакция идет медленно. Наоборот, если к+1 велика и к- 1 мала, то КS будет мала и ферментативная реакция будет идти быстро. Исходя из закона действующих масс, можно записать следующее уравнение (слайд 6):
где [ Е0 ] — концентрация фермента в начале ферментативной реакции, [ S ] — концентрация субстрата, ЕS — концентрация комплекса «фермент-субстрат», [ Е0 ] — [ ЕS ] — концентрация фермента, не связанного в комплексе с субстратом. Далее можно преобразовать данное уравнение (слайд 7):
Следовательно, чем больше выражение [ ЕS ], тем больше скорость данной ферментативной реакции. Максимальная скорость данной ферментативной реакции достигается тогда, когда концентрация соединения фермент-субстрат равна общей концентрации фермента, т.е. [ ЕS ] = [ Е0 ]. Следовательно, скорость будет максимальной при условии, что вест фермент войдет в соединение с субстратом и будет им полностью насыщен. Таким образом, можно написать следующую зависимость:
Т.е. скорость данной реакции так относится к максимальной скорости реакции, как [ ЕS ] относится к [ Е0 ]. Но мы знаем, что
И таким образом, получаем
Преобразуя представленное выше уравнение, получим выражение, которое будет иметь следующий вид:
Это уравнение названо уравнением Михаэлиса- Ментен. Оно имеет огромное значение для выражения зависимости действия ферментов от концентрации субстрата. Из этого уравнения следует, что если концентрация субстрата велика по сравнению с КS (например, при гидролизе сахарозы β-фруктофуранозидазой КS составляет 0,0167 М), то в соответствии с уравнением Михаэлиса-Ментен скорость реакции будет равна максимальной (V=Vmax), поскольку добавление очень небольшой величины КS к концентрации субстрата практически не изменит ее значение. Для большего удобства уравнение Михаэлиса-Ментен было преобразовано Лайнуивером-Берком на основании того принципа, что если имеется равенство между двумя какими либо величинами, то и обратные величины тоже будут равны. В таком случае уравнение Михаэлиса-Ментен будет выглядеть следующим образом (слайд 10):
Иначе его можно написать в таком виде:
Метод двойных обратных величин широко распространен и используется для получения кинетических данных, характеризующих тот или иной фермент. Уравнение Михаэлиса-Ментен правильно только лишь при самых коротких сроках действия фермента, т.е. тогда, когда имеется избыток субстрата и образовалось мало продуктов реакции, т.е. не учитывалась вторая стадия ферментативной реакции — образование Е и Р. В связи с этим был предложен ряд усовершенствованных уравнений, с учетом влияния образовавшихся продуктов реакции. В настоящее время наиболее широко используют уравнение Д. Холдейна — Д. Бриггса. Оно имеет следующий вид (слайд 11):
В этом уравнении вместо КS — константы диссоциации комплекса ЕS, который присутствует в уравнении Михаэлиса — Ментен, стоит Кт — константа Михаэлиса (является важной характеристикой фермента) (в числителе которой находятся константы скоростей реакций, ведущих к распаду комплекса ЕS в двух направлениях (слайд 5)):
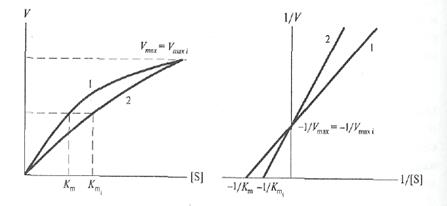
Поскольку Константу Михаэлиса выражают в молях на литр. Если V =1/2 Vmax, то [S]=Km. Константа Михаэлиса равна той концентрации субстрата (моль/л), при которой наблюдается скорость реакции, равная половине максимальной. Кт всегда несколько больше Кs, например в случае фермента алкогольдегидрогеназы, катализирующего в присутствии НАД+ реакцию окисления этилового спирта с образованием уксусного альдегида, Кs =10-7 моль/л, а Кт =10-5моль/л. При выделении нового фермента очень важно знать константу Михаэлиса, ее определяют по возможности с наиболее чистыми ферментативными препаратами, при строго определенных условиях (температура, рН и т.д.) и по возможности за самый короткий начальный период реакции. Графически константа Михаэлиса может быть представлена следующим образом (слайд 14), а уравнение Лайнуивера-Берка будет иметь следующий вид (слайд 15)
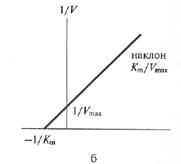
Рис. 4. Влияние концентрации субстрата на начальную скорость ферментативной реакции (а — по методу Михаэлиса-Ментен, б — по методу Лаийуивера—Берка) Приблизительное значение Кт можно получить простым графическим способом, как это показано на рис. 8.4а (слайд 14); однако в этом способе достаточно велика погрешность в нахождении Vmax. Значительно удобнее пользоваться прямолинейной зависимостью при обработке данных по методу двойных обратных величин (слайд 15). В этом случае можно получить более точное значение Кт. Источником множества недоразумений как в прошлом, так и в настоящем, является некорректное использование термина «константа Михаэлиса» и двух символов Кs и Кт для обозначения величин отнюдь неидентичных, несмотря на совершенно четкие рекомендации Комиссии по ферментам Международного Биохимического Союза. Первая величина — Кs— константа равновесия, характеризует сродство фермента к субстрату (или, иначе, прочность комплекса ЕS), причем существует обратная пропорциональность между величиной Кs и сродством фермента к субстрату. Вторая величина — Кт — соответствует концентрации субстрата, при которой V= Vmax/2. Часто свойство Кs ошибочно приписывают Кт. На самом деле Кт будет являться мерой сродства фермента к субстрату только в том единственном случае, когда величина k+2 будет настолько мала, что Кт практически совпадет с Кs. (Многие ферменты катализируют реакции с участием двух субстратов. К так называемым бимолекулярным реакциям относятся реакции переноса химических группировок с одного соединения на другое, реакции синтеза, окислительно-восстановительные реакции. Такие реакции могут протекать по двум различным механизмам. В реакциях первого типа, называемых реакциями единичного замещения, два субстрата А и В образуют с ферментом комплекс ЕАВ, который затем распадается с образованием продуктов реакции С и Д. Второй тип двухсубстратных реакций протекает по механизму двойного замещения (механизм типа «пинг-понг»). В этих реакциях с активным центром фермента в каждый момент времени связан только один из двух субстратов. При исследовании кинетики бимолекулярных реакций концентрацию одного из субстратов оставляют постоянной (В), а второго — изменяют (А). В этом случае в координатах 1/ V от 1/[А] можно получить «кажущееся» значение Кт, Истинное значение Vmax и Кт В получают при исследовании нескольких концентраций субстрата В. Точно так же поступают при определении Кт А (когда концентрация А постоянна, а концентрация В варьируется). Кт по отношению к различным субстратам в одной и той же реакции могут быть различными — это хорошо видно из следующего примера. Реакция катализируемая алкогольдегидрогеназой: СН3СН2ОН + НАД+ ↔ СН3СОН + НАДН + Н+ Этанол Уксусный альдегид Значение Кт для алкогольдегидрогеназы дрожжей: Субстрат Кт, М/л НАД+................................................ 1,0 х 10-4 СН3СН2ОН 2,4 х 10-2 НАДН + Н+ 3,5 х 10-5 СН3СОН........................................... 1,0 х 10-4
Ингибирование избытком субстрата или продукта реакции. При большом избытке субстрата кривые зависимости скорости реакции от концентрации субстрата имеют вид, представленный на рис. 5 (слайд 19). Механизм ингибирующего действия избытка субстрата может быть весьма разнообразным. На рис. 6 (слайд 20) схематически представлены различные случаи субстратного ингибирования. Если имеет место субстратное ингибиронание по типу а, т. е. когда молекула субстрата соединяется с двумя (или более) функциональными группами фермента, то возможно, что при очень высокой концентрации субстрата к этим группам присоединяются сразу две (или более) молекулы субстрата, как показано в правой части рисунка. В результате образуется неактивный фермент-субстратный комплекс в соответствии с уравнением
Е + 2S ↔ ЕS2.
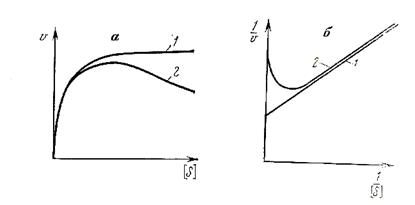
Рис. 5. Зависимость скорости ферментативной реакции от концентрации субстрата при его тормозящем действии а - кривые Михаэлиса-Ментен при: 1 - нормальном течении реакции, 2 - в случае ингибирования избытком субстрата; б - графическое изображение по Лайнуиверу-Берку при: 1 - нормальном течении реакции, 2 - в случае ингибирования избытком субстрата
Рис. 6. Схематическое изображение возможных механизмов субстратного ингибирования Слева — схемы нормального положения, когда образуется обычный фермент-субстратный комплекс, обеспечивающий течение реакции; справа - положения, при которых происходит субстратное ингибированис (а – д - различные типы субстратного инги-бирования; 1 и 2 — различные функциональные группы субстрата, взаимодействующие с ферментом; А - акцептор; Д - донор)
Если реакция идет по типу б, то для того, чтобы она прошла, субстрат должен присоединиться к ферменту лишь в одном месте (слева); однако субстрат может присоединиться и к другой функциональной группе фермента (справа), и образующийся при этом фермент-субстратный комплекс будет неактивен. В случае в для действия фермента необходим активатор (на рисунке затушеван), но при большом избытке субстрата этот последний связывает активатор и фермент инактивируется. Следующий тип субстратного ингибирования представлен схемой г. В данном случае настоящим субстратом является соединение субстрата и активатора (слева); при значительном избытке субстрата этот последний, связываясь с ферментом (справа), может подменять истинный субстрат. Тип субстратного ингибирования, обозначенный буквой д, касается реакций переноса различных групп с одного субстрата на другой (слева — с донора Д на акцептор А); избыток субстрата препятствует нормальному течению реакции, поскольку один донор может препятствовать нормальному соединению акцептора с ферментом. Ингибирование ферментативной реакции продуктами реакции может происходить двояким образом. Поскольку большинство ферментативных реакций обратимо, накопление продуктов реакции вызывает сдвиг равновесия в обратную сторону, и вследствие этого прямая реакция замедляется. Однако в данном случае нужно иметь в виду, что в большинстве ферментативных реакций равновесие сдвинуто в какую-то одну сторону и обратная реакция протекает медленно. Другой тип ингибирования продуктом реакции заключается в том, что продукт реакции может связываться с ферментом или другим компонентом ферментной системы (активатором, коэнзимом) и, инактивируя фермент, таким образом снижать скорость реакции. Примером подобного действия продукта реакции является ингибирование гексокиназы. Гексокиназа катализирует следующую реакцию:
D-Гексоза + АТФ ↔ D-гексозо-6-фосфат + АДФ
Гексокиназа мозга очень сильно подавляется продуктом этой реакции — глюкозо-6-фосфатом. Однако тут же нужно отметить, что на дрожжевую гексокиназу глюкозо-6-фосфат не действует. Таким образом, в данном случае мы имеем пример того, что один и тот же фермент, но полученный из различных организмов, может сильно различаться по своим свойствам, что, вероятно, связано с особенностями его первичной, вторичной, третичной и четвертичной структур. Влияние концентрации фермента на скорость ферментативной реакции. Концентрация фермента оказывает существенное влияние на скорость ферментативной реакции. При насыщающей концентрации субстрата, обеспечивающей Vmax, начальная скорость ферментативной реакции будет, в первую очередь, зависеть от концентрации фермента. Эта зависимость прямопропорциональная, что свидетельствует о том, что начальная скорость является мерой количества фермента. Графически это представлено на рис. 7.
Рис. 7. Влияние концентрации фермента [Е] на скорость ферментативной реакции (V). Влияние температуры на активность ферментов. Общий вид кривой, характеризующей влияние температуры на активность фермента, можно представить в виде графика, изображенного на рис. 8.
Рис. 8. Влияние температуры на скорость расщепления комплекса ЕS Оптимальная температура, при которой наблюдается максимальная активность, для большинства ферментов находится в пределах 37-50°С, но некоторые ферменты имеют температурный оптимум за пределами этой зоны. Влияние температуры на активность фермента, которое может быть легко изучено экспериментально, имеет очень сложный характер, так как обусловлено целым рядом факторов, а именно: — влиянием температуры на скорость расщепления комплекса ЕS на свободный фермент и продукт реакции, т. е. на константу скорости реакции k+2, — влиянием температуры на сродство фермента к субстрату, то есть на константы k +1 и k-1; — влиянием на теплоту ионизации, а, следовательно, на процессы ионизации всех компонентов реакции: самого фермента, субстрата, промежуточных и конечных продуктов реакции; — влиянием на образование таких соединений, как «фермент—активатор» или «фермент—ингибитор»; —влиянием на процесс денатурации ферментного белка. Известное уравнение Аррениуса, характеризующее влияние температуры на скорость химической реакции, может быть приложено к левой части температурной кривой (см. рис. 8):
где k - константа скорости реакции; T - абсолютная температура, °К; Е -энергия активации; R - универсальная газовая постоянная. Изменение скорости ферментативной реакции при повышении температуры измеряется температурным коэффициентом Q10, который показывает, во сколько раз ускоряется данная реакция при повышении температуры на десять градусов. Можно преобразовать уравнение Аррениуса, подставив в него коэффициент Q10:
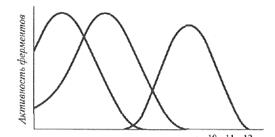
Это уравнение дает возможность определить энергию активации путем определения значений Q10 для данной ферментативной реакции. Для обычных химических реакций Q10 = 2—3, для ферментативных реакций (левая часть температурной кривой) Q10= 1-2, причем значение Q10 =1 характерно для температур, близких к оптимальным. Правая часть температурной кривой показывает резкое снижение скорости ферментативной реакции при температурах, превышающих оптимальную. И это зависит, в первую очередь, от денатурации ферментного белка. Поэтому очень важным показателем, характеризующим отношение фермента к температуре, является его термостабильность. Термостабильность фермента складывается как бы из двух критериев: величины температуры и времени ее воздействия на фермент. Кроме того, на термостабильность различных ферментов могут оказывать влияние и такие факторы, как рН среды, ее солевой состав, защитное действие субстрата. Обычно для определения термостабильности фермента берут его раствор и наполняют им серию пробирок. Эти пробирки помещают в термостат при разных температурах, например при температуре 20, 30, 40, 50° и т.д., и выдерживают их там в мечение определенного времени. В эти пробирки субстрат не добавляют. По окончании инкубации содержимое всех пробирок охлаждают, добавляют в них субстрат и затем проводят реакцию при одной и той же температуре, например при 50°С (выбирают температуру, оптимальную для действия данного фермента). Таким образом, сравнивают активность фермента, предварительно прогретого при разных температурах. При этом очень важно, чтобы кривые, характеризующие влияние температуры на фермент, т.е. его термостабильность, были получены при строго определенных условиях: определенном значении рН и определенном солевом составе среды. Дело в том, что один и тот же фермент при одном рН может быть более термостабилен, чем при другом. Так, например, пепсин хорошо выдерживает прогревание в кислой среде и быстро инактивируется при нагревании в щелочной среде. Большое влияние на термостабильность фермента оказывает присутствие субстрата. Многие ферменты, например оксидаза D-аминокислот, глютаматдегидрогеназа, лактатдегидрогеназа, бактериальная и грибная α-амилазы, могут быть защищены от денатурации и инактивации соответствующими коферментами или субстратами. Защитное действие субстрата объясняется тем, что, связываясь с ферментом и образуя соединение фермент – субстрат, он стабилизирует его вторичную и третичную структуру, делая ее более устойчивой ко всяким неблагоприятным, в том числе температурным, воздействиям. Очень высокой термостабильностью обладают ферменты термофильных микроорганизмов, способных жить и развиваться при повышенных температурах. Так, например, кристаллическая α-амилаза термофильной споровой бактерии вида Bacillus не теряет своей активности после нагревания в течение 24 ч при 70°С. Влияние рН на активность ферментов. Для каждого фермента характерна определенная узкая область значений рН, при которой он проявляет максимальную активность.
1 2 3 4 5 6 7 8 9 10 11 12 Рис. 9. Кривые, характеризующие зависимость активности фермента от рН
Форма кривых, описывающих зависимость активности фермента от рН, отражает способность важных для данного фермента протон-донорных или протон-акцепторных групп в активном центре фермента переходить в состояние с требуемой степенью ионизации при определенных значениях рН (см. рис. 9). Кроме влияния рН на состояние ионизации активного центра фермента, ход представленных кривых будет зависеть и от других факторов. В частности, изменение рН среды изменяет состояние ионизации субстрата (если это заряженное вещество), комплексов ЕS и ЕР, в некоторых, например, окислительно-восстановительных реакциях, ионы Н+ сами могут принимать участие в реакции; помимо этого, скорость денатурации ферментативного белка зависит от рН. При экспериментальном изучении активности фермента от рН следует помнить, что рН-оптимум зависит от состава среды (от природы используемого буфера); оптимумы рН прямой и обратной реакции могут быть совершенно различными; при действии одного и того же фермента на различные субстраты рН-оптимумы также могут быть различными. Кроме понятия оптимума рН, очень важным является понятие рН-стабильности. Это тот диапазон рН, при котором фермент или ферментативный препарат сохраняет свою активность в течение определенного периода времени. рН-Стабилъность также зависит от ряда факторов, среди которых, кроме уже названных, форма ферментного препарата, степень его очистки и др. Все выше сказанное позволяет утверждать, что варьируя температурный режим и изменяя рН, можно в какой-то мере регулировать каталитическую активность фермента. Ход кривой, показывающей влияние рН на действие фермента, зависит от целого ряда факторов. 1. поскольку фермент является в большинстве случаев белком и содержит различные ионизирующие группы, изменение рН среды изменяет состояние ионизации этих групп, а следовательно, и заряд белковых молекул. Взаимодействие субстрата с ферментом зависит от распределения зарядов в молекуле этого последнего. 2. если субстрат имеет заряды, то сродство его разных ионных форм к ферменту различно. 3. превращение комплекса фермент-субстрат и комплекса фермент-продукт может происходить лишь при каком-то определенном состоянии ионизации комплекса. 4. в некоторых ферментативных реакциях водородные или гидроксильные ионы могут непосредственно участвовать в реакции. Это наблюдается при окислительно-восстановительных реакциях. 5. скорость денатурации и инактивации фермента зависит от рН. Следовательно, рН оказывает влияние на стабильность фермента. Оптимум рН для действия фермента зависит также от концентрации тех или иных ионов в реакционной среде. Например, для щелочной фруктозодифосфатазы из листьев шпината, катализирующей гидролиз фруктозо-1,6-дифосфата до фруктозо-6-фосфата, показано, что при повышении концентрации Мg2+ в растворе оптимум рН сдвигается от 8,5 до 7,5. Одна и та же ферментативная реакция, катализируемая данным ферментом, может иметь различный оптимум рН в зависимости от того, идет ли речь о прямой или обратной реакции. Так, например, лактатдегидрогеназа бактерии Bacillus subtilis при окислении лактата имеет оптимум рН 7,2, а при обратной реакции – восстановлении пирувата до лактата – оптимум находится при рН 6,0. Влияние активаторов и ингибиторов. Активаторами называют вещества, которые повышают активность ферментов. Хорошим примером таких соединений являются аминокислота цистеин и восстановленный глутатион, содержащие свободную SН-группу. Их активирующее действие заключается в том, что они восстанавливают дисульфидные связи с образованием SН-групп, необходимых для проявления каталитической активности тиоловых ферментов. Кроме того, некоторые ферменты активируются металлами, которые либо участвуют в построении активного центра, либо стабилизируют пространственную конформацию ферментного белка и тем самым обеспечивают проявление каталитических функций. Ингибиторами называют вещества, специфически снижающие активность ферментов. Снижение или полная потеря активности ферментов могут быть вызваны разного рода денатурирующими воздействиями, в этом случае правильнее употреблять термин «инактивация» фермента. Механизм действия ингибиторов может быть самым разнообразным: — ингибитор взаимодействует с апофсрментом, при этом возможны такие варианты, как связывание функциональных групп белка, изменение третичной и четвертичной структуры апофермента, специфическое связывание с определенным участком апофермента, неспецифическая адсорбция на белке; — ингибитор образует комплекс с субстратом; — ингибитор связывает кофермент; — ингибитор связывает активатор; ингибитор связывает кофактор. Чаще всего ингибитор взаимодействует с ферментом, образуя комплекс. Это можно выразить следующим уравнением:
Константа диссоциации комплекса фермент—ингибитор (или константа ингибирования) Ki. определяется выражением:
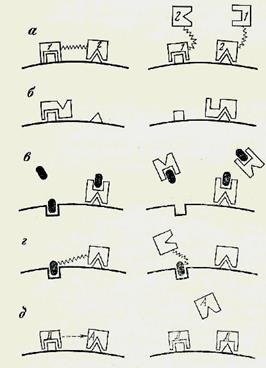
Кi прямо пропорциональна концентрации фермента и ингибитора и обратно пропорциональна концентрации комплекса фермент - ингибитор. Чем меньше эта последняя величина, тем сильнее ингибитор, тем он активнее. Применение различных ингибиторов имеет очень большое значение в энзимологии. Ингибиторы используются, во-первых, для изучения и идентификации функциональных групп ферментов и для выяснения тех химических связей, которые возникают при образовании комплекса фермент - субстрат. Известен целый ряд соединений, которые специфически связывают те или иные группы в молекуле фермента. Так, например, с этой целью широко применяются различные соединения, блокирующие SН-группы. К их числу принадлежит иодацетамид - JCH2-CONH2, этилиодацетат - JCH2-CO-O-C2H5 и n- хлормеркурибензоат. Реактивами на содержащиеся в ферментах металлы (железо и медь) являются цианид и диэтилдитиокарбамат, а также азид натрия NaN3. Эти соединения очень широко применяются в биохимии и энзимологии, особенно при изучении окислительно-восстановительных ферментов. Однако нужно иметь в виду, что их действие неспецифично, так как они ингибируют и ряд ферментов, не содержащих металлы, например некоторые пиридоксалевые ферменты. Ингибиторы применяются для того, чтобы можно было определить сходство и различие фермента одного и того же наименования, но получаемого из разных источников. На примере лактатдегидрогеназы показано, что ингибиторы, угнетающие действие дегидрогеназ, могут быть применены для того, чтобы выяснить, одинаковы ли свойства у препаратов этого фермента, полученных из разных организмов или даже из одного организма. Так, например, в печени присутствуют различные молекулярные формы лактатдегидрогеназы, которые могут быть разделены с помощью электрофореза. Выяснилось, что эти различные формы лактатдегидрогеназы (изоэнзимы), имеющие различные электрохимические свойства, но катализирующие одну и ту же реакцию, по-разному относятся к одному и тому же ингибитору - n- хлормеркурибензоату. Было установлено, что разные формы лактатдегидрогеназы содержат разные количества свободных SН-групп и поэтому отличаются друг от друга по концентрации ингибитора, которая требуется для их полной инактивации. Применение ингибиторов очень важно для выяснения механизма действия лекарств, ядов, антибиотиков, гербицидов, стимуляторов роста, т. е. различных физиологически активных соединений. В большинстве случаев действие того или иного физиологически активного соединения сводится к тому, что оно стимулирует или ингибирует какую-то определенную ферментативную реакцию. Огромное число исследований посвящено вопросу о возможности лечения различных заболеваний путем ингибирования тех или иных ферментативных процессов. Механизм действия ингибиторов может быть самым разнообразным (рис. 10). Нормальное взаимодействие апофермента, коэнзима, кофактора и субстрата, обеспечивающее течение данной ферментативной реакции, показано в самом верху схемы (1 и 2 изображают либо два субстрата, либо субстрат и коэнзим; х – кофактор, например ион какого-то металла; молекула ингибитора во всех случаях изображена черным цветом). Схемы а, г, ж и к иллюстрируют случаи, когда ингибитор как бы подменяет субстрат, полностью или частично занимая соответствующее место в молекуле апофермента. В некоторых случаях, как это показано на схеме е, ингибитор соединяется с участком молекулы апофермента, прилегающим к тому месту, где должен присоединиться субстрат, и стерически или электростатически, так сказать, «отталкивает» его. Схемы в и д иллюстрируют те случаи, когда ингибитор, соединяясь с апоферментом, не допускает к нему коэнзим, а схема з - тот случай, когда ингибитор «не допускает» к апоферменту и субстрат и коэнзим. В случае, обозначенном б, ингибитор, связываясь с апоферментом, подменяет и поэтому не допускает кофактор к участию в образовании комплекса фермент - субстрат. На схемах л, м и н показаны те случаи, когда ингибитор связывается с субстратом, коэнзимом или коферментом и, следовательно, препятствует образованию активного комплекса фермент - субстрат. Наконец, буквой и обозначен тот случай, когда ингибитор, связываясь с каким-то местом молекулы апоформента, так изменяет нативную конформацию последнего, что становится невозможным необходимое для осуществления ферментативной реакции сближение субстрата, кофактора и коэнзима. В этом последнем случае возможно не только ингибирование, но и активирование фермента - присоединение к апоферменту какого-то соединения может вызвать такое изменение конформации апофермента, которое будет способствовать сближению и взаимодействию субстрата, кофактора и коэнзима, а следовательно, повысит активность фермента в целом.
Рис. 10. Механизм действия ингибиторов 1 и 2 изображают либо два субстрата, либо субстрат и коэнзим; х — кофактор, например ион какого-то металла; молекула ингибитора во всех случаях изображена черным цветом (а – н - схемы различных механизмов действия ингибиторов)
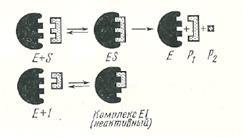
Говоря об ингибировании ферментативных реакций, нужно прежде всего различать обратимое и необратимое ингибирование. В идеальном случае необратимое ингибирование будет иметь место тогда, когда к- 1 равна нулю, т. е. соединение фермент - ингибитор настолько прочно, что оно совершенно не диссоциирует. Однако такие случаи редки, и для большинства так называемых необратимых ингибиторов величина к- 1 хотя и очень мала, но не равна нулю. Примером необратимого ингибирования может служить действие цианида на фермент ксантиноксидазу. Хорошим примером обратимого ингибирования фермента является снятие избытком янтарной кислоты ингибирующего действия малоната на сукцинатде-гидрогеназу. Различают конкурентное и неконкурентное ингибирование ферментативных реакций. Конкурентное ингибирование заключается в том, что ингибитор обратимо связывается с тем же местом в молекуле фермента, с которым обычно связывается субстрат (рис. 11). Между молекулами фермента и субстрата имеется соответствие - условно это изображено таким образом, что молекула субстрата как бы пригнана к молекуле фермента. Это структурное соответствие обеспечивает образование соединения фермент - субстрат, которое затем расщепляется, причем возникают продукты реакции и молекула фермента регенерируется в неизменном виде. Если мы имеем дело с конкурентным ингибитором, то взаимодействие его с ферментом схематически изображено в нижней части рисунка.
Рис. 11. Схематическое изображение действия конкурентного ингибитора Е - фермент; S - субстрат; I - ингибитор; Р1 и Р2 - продукты реакции
Конкурентный ингибитор имеет строение, которое лишь незначительно отличается от строения субстрата. Поэтому молекула конкурентного ингибитора может соединиться с ферментом в том же месте, где с ним соединяется и субстрат, и тем самым как бы подменить субстрат, который уже не может связаться с ферментом. Следовательно, конкурентный ингибитор снижает сродство субстрата к ферменту, и поэтому значение константы Михаэлиса, определяемое в присутствии ингибитора, увеличивается. Конкурентное торможение обратимо. Соединение фермента с ингибитором распадается при добавлении избытка субстрата. Таким образом, конкурентное торможение - это такое торможение, когда ингибитор обратимо соединяется с ферментом в том же; участке его молекулы, в котором присоединяется и субстрат, причем ингибитор может быть вытеснен из комплекса фермент - ингибитор избытком субстрата. Классический пример конкурентного торможения — это ингибирование малоновой кислотой действия ферментной системы, которая названа сукцинатдегидрогеиазой (дегидрогеназой янтарной кислоты ). Эта система катализирует следующую реакцию:
HOOC-CH2-CH2-COOH-−−−−−→−2H+←+2H+------HOOC-CH=CH-COOH
Эта ферментная система конкурентно ингибируется малоновой кислотой или ее солями. Малоновая кислота является гомологом янтарной кислоты и отличается от нее только одной метиленовой группой. Если мы добавим в реакционную смесь небольшое количество малоновой кислоты, то она будет частично ингибировать реакцию. Если прибавим большое количество малоновой кислоты, то произойдет полное ингибирование. Однако если мы в реакционную смесь добавим избыток субстрата, т. е. янтарной кислоты, которая вытеснит малонат из соединения с ферментом, то реакция снова пойдет. При неконкурентном торможении ингибитор связывается с ферментом не в том мосте его молекулы, где связывается субстрат, а где-то, так сказать, «с другой стороны» молекулы, в другом ее месте. Очевидно, что в этом случае ингибитор не должен оказывать влияния на величину константы Михаэлиса Кт, но просто будет снижать максимальную скорость реакции. Примером неконкурентного ингибирования является действие синильной кислоты. Синильная кислота необратимо связывается разными ферментными системами, содержащими железо, осуществляющими перенос электронов при окислительно-восстановительных реакциях. Синильная кислота ингибирует также ферменты, содержащие в своем составе медь, как, например, о(омикрон) -дифенолоксидазу (полифенолоксидазу). Ингибирующее действие синильной кислоты объясняется тем, что она образует прочное соединение с металлом, входящим в состав фермента. Говоря о конкурентном и неконкурентном ингибировании, нужно иметь в виду, что в целом ряде случаев имеет место смешанный тип ингибирования, при котором ингибитор оказывает влияние как на константу Михаэлиса, так и на максимальную скорость ферментативной реакции.
Рис. 12. Конкурентное ингибирование 1-без ингибитора; 2- с конкурентным ингибитором
Рис. 13. Неконкурентное ингибирование: 1 - без ингибитора; 2 - с неконкурентным ингибитором Одними из самых распространенных неконкурентных ингибиторов являются аллостерические ингибиторы. Присоединяясь не к активному, а к другому, так называемому аллостерическому центру молекулы фермента, ингибитор вызывает конформационные изменения в структуре активного центра, вследствие чего становится невозможным образование комплекса фермент—субстрат. Изучение взаимодействия ферментов с ингибиторами и активаторами ферментов позволяет получать ценные сведения о субстратной специфичности ферментов, пр
|


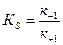
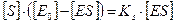
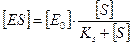 ,
,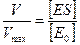 ,
,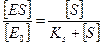 ,
,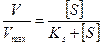 ,
,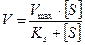




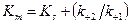 , то есть Кт всегда больше Кs.
, то есть Кт всегда больше Кs.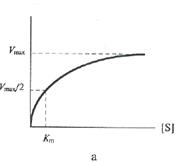
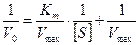 уравнение Лайнуивера-Берка
уравнение Лайнуивера-Берка