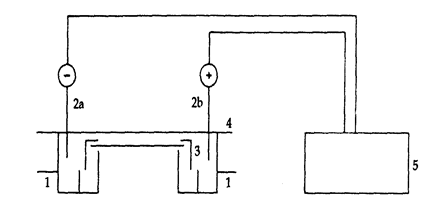
Тема: Аналитические основы клинической лабораторной диагностики.Лекция № (материалы к занятию №10). Электрофорез Электрофорез - метод разделения заряженных частиц при движении их в растворе под действием внешнего электрического поля. Метод основан на свойстве ионизированных, т. е. несущих заряд, молекул двигаться к электродам. В растворе более кислом, чем изозлектрическая точка растворенного вещества, амфолит способен приобретать положительный или отрицательный заряд. Связывая протоны, вещество становится заряженным положительно и двигается к отрицательно заряженному катоду; при потере протонов, приобретая отрицательный заряд, молекула движется к положительно заряженному аноду. Широкое практическое применение приобрел зональный электрофорез, представляющий собой миграцию в пористой поддерживающей среде заряженных молекул, образующих зоны, которые затем могут выявляться окрашиванием тем или иным специфическим красителем с последующей элюцией и фотометрией или прямой денситометрией. Процедура электрофореза состоит в том, что гидратированный поддерживающий материал помещается в электрофоретическую камеру, содержащую буферный раствор. (рис. 1). Проба наносится на поддерживающий материал. Устанавливается требуемая постоянная сила тока или напряжение. Процесс разделения протекает необходимый промежуток времени. Поддерживающий материал вынимают из камеры и быстро высушивают или помещают в закрепитель для предупреждения диффузии компонентов пробы. Зафиксированный поддерживающий материал окрашивают, чтобы выявить зоны отдельных белков. После удаления из белка красителя поддерживающий материал высушивают или обрабатывают просветляющим реагентом.
Рис. 1. Схема устройства аппарата для электрофореза. 1. Камеры с буферным раствором. 2. Электроды: 2а - анод, 2b - катод. 3. Твердый носитель для разделения фракций. 4. Крышка. 5. Источник постоянного тока. Скорость миграции молекул зависит от электрического заряда молекулы, ее размера, силы электрического поля, свойств поддерживающей среды, температуры. Электрофоретическая подвижность частицы, молекулы прямо пропорциональна ее заряду и обратно пропорциональна размеру частицы и вязкости раствора (электрофоретического буфера). Буферный раствор проводит электрический ток и благодаря своей рН определяет электрический заряд растворенного вещества. Наиболее часто применяется барбиталовый буфер и трис-буфер. Ассоциация с белком оснований в этих буферных растворах минимальна. Для визуализации зон на электрофореграмме применяются различные красители. Для окрашивания электрофореграмм белков крови используют амидочерный, бромфенол голубой, кумасси бриллиантовый-голубой, Понсе S. За разделением фракций белков должна следовать их идентификация и количественная оценка. Идентификация осуществляется по положению зон по отношению к месту старта или по сопоставлению с параллельно разгоняемой пробой со стандартным образцом. При обычном электрофорезе белков сыворотки крови проба обычно делится на 5 фракций; альбумины, а1-глобулины, а2-глобулины, β-глобулины, γ-глобулины. При некоторых условиях эти типичные зоны могут выглядеть необычно. Так, расширение зоны альбумина может быть результатом наличия в крови связанных с альбумином медикаментов, вводимых пациентам. Необычная зона между а1- и β-глобулинами может отражать наличие в крови гемоглобин-гаптоглобинового комплекса. Расширение зоны β-глобулинов может быть следствием гемолиза, поскольку гемоглобин движется в этой зоне. Полоса в месте нанесения пробы может быть следом фибриногена, денатурированного белка из испорченной сыворотки, результатом повреждения ацетатцеллюлозной мембраны аппликатором. Наличие значительного числа зон индивидуальных белков на полиакриламидной фореграмме требует для их идентификации параллельной фореграммы, заведомо содержащей известный белок, который хотят отыскать в изучаемой пробе. Иногда искомый белок приходится идентифицировать иммунологическим методом с помощью соответствующего ему антитела. Количественная оценка соотношений фракций белков осуществляется с помощью прямой денситометрии (в последнее время - преимущественно таким образом) либо путем фотометрии элюатов отдельных полос электрофореграммы. Отдельные окрашенные полосы носителя вырезаются, помещаются в определенный объем растворителя (основного буфера, спиртового раствора), элюаты фотометрируют. Результаты выражают либо в процентах по отношению к сумме всех отсчетов, принятой за 100, либо соотносят с содержанием общего белка и выражают в единицах массовой концентрации. Денситометрия состоит в сканировании просветленных, окрашенных и зафиксированных полос носителя. Результаты выражаются в графической форме череды пиков и в цифровой форме процентных соотношений. Различные красители требуют различных длин волн. В зависимости от типов носителей, в которых происходит разделение веществ, различают электрофорез на бумаге, на ацетате целлюлозы, в геле (крахмала, агарозы, агара, полиакриламида), в тонком слое сорбента (окиси кремния, кизельгура, окиси алюминия, целлюлозы). Электрофорез на геле агарозы используется для разделения белков сыворотки крови, вариантов гемоглобина, изоферментов лактатдегидрогеназы, фракций липопротеинов и т. п. Мембраны ацетилированной целлюлозы представляют собой переплетение волокон, между которыми располагаются заполненные воздухом полости. При погружении мембраны в буфер полости заполняются жидкостью. Электрофорез на полиакриламидном геле - позволяет выделить 20 и более фракций белков, включая изоферменты и генетические варианты. В этом варианте электрофоретического разделения используется несколько слоев геля, отличающихся составом и величиной пор. В связи с неоднородностью поддерживающего материала и дискоидной формой зон белков этот вариант иногда называют диск-электрофорезом. Первоначально технология приготовления многослойного геля состояла в полимеризации мономерного геля и реагента, образующего перекрестные связи, под действием катализатора. Этот разделительный слой имеет мелкие поры, размером около 5 нм. Поверх него образуется слой геля с широкими порами. Третий, верхний слой образован гелем с широкими порами, содержащим 3 мкл сыворотки. При проведении электрофореза белковые ионы проходят через слой с широкими порами и задерживаются вдоль конца разделительного геля, образуя очень тонкие зоны, распределение которых зависит не только от заряда молекул, но и от их размера. Это обстоятельство и позволяет разделять многие варианты белков сыворотки. Современные варианты этой технологии упрощены за счет исключения образования двух последних слоев. Неразведенная сыворотка наносится прямо на верхнюю поверхность разделительного слоя. Полиакриламидный гель термостабилен, прозрачен, химически почти инертен, не обладает зарядом. Электрофорез на крахмальном геле также позволяет распределять ионизированные макромолекулы на основе величины заряда и размера молекул. Высоковольтный электрофорез - благодаря применению более высокого, чем обычно, напряжения электрического тока достигается разделение относительно слабо заряженных веществ (например, метаболиты катехоламинов. Современные технические средства позволяют автоматизировать процедуру электрофореза, начиная от нанесения пробы на носитель и заканчивая выдачей результатов в графической и цифровой формах. Капиллярный электрофорез - осуществляется в капиллярных трубках, что позволяет уменьшить объем исследуемого образца до нескольких нанолитров, значительно сократить время разделения (до нескольких минут), повысить точность определения, автоматизировать процедуру разделения веществ. Различные варианты метода используются для разделения белков, углеводов, ДНК, лекарств, метаболитов. Мультикапиллярные устройства позволяют осуществлять параллельное разделение нескольких видов аналитов, например, сывороточных белков, иммуноглобулинов, гемоглобинов и т. п. Капиллярный электрофорез применим и в микроустройствах для разделения различных аналитов, так называемых микрочипах. Комбинация электрофореза с иммунофиксацией и субтракцией позволяет точно определять специфичность белкового расстройства. Иммунофиксация состоит в связывании фракций белков сыворотки со специфическими антителами, закрепленными в лунках сефарозы. Связавшаяся с антителом фракция белка не выявляется при последующем электрофорезе сыворотки. В данном варианте метода проба разведенной сыворотки наносится на 5 различных подложек, каждая из которых содержит специфическое антитело - три из них специфичны для тяжелых цепей иммуноглобулинов (IgG, IgA, IgM), а два - по одной - для легких цепей - каппа и лямбда. После контакта с твердой подложкой проба подвергается электрофорезу параллельно с необработанной пробой сыворотки. Специфический иммуноглобулин идентифицируется отсутствием соответствующего пика при сравнении с референтной электрофореграммой.
|