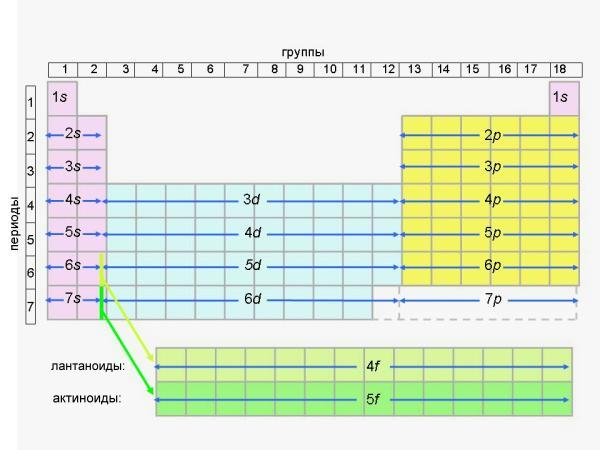
Элементы побочных подгрупп (d-элементы) называют ПЕРЕХОДНЫМИ элементами или переходными металлами (все d-элементы - металлы).Термин “переходные металлы” возник вследствие того, что все d-элементы в периодах (строчках таблицы) служат как бы “переходным мостиком” от металлических s-элементов к p-элементам, среди которых уже много неметаллов. Иногда термин “переходные металлы” применяют и к f-элементам, о которых мы расскажем в следующем параграфе. Поскольку в периодах (горизонтальных строчках Периодической таблицы) имеется всего по 2 s-элемента и по 6 p-элементов (в сумме 8), а d-элементов по определению должно быть больше (10 в каждом периоде), возникла масса неудобств в оформлении таблицы. Например, в VIII группе вместе с инертными газами (главная подгруппа) пришлось расположить не по одному, а по 3 элемента побочной подгруппы в каждой строчке! Разумеется, ярко выраженные металлы - железо (Fe), кобальт (Co), никель (Ni) и другие элементы этой побочной подгруппы ничего общего не имеют с элементами главной группы: гелием, неоном, аргоном и другими инертными газами. Электронное строение и химические свойства элементов главных и побочных подгрупп могут не иметь ничего общего. Совпадения носят скорее случайный характер. Например, скандий (Sc) имеет валентную оболочку из трех электронов:...4s2 3d1, поэтому проявляет в соединениях валентность III и степень окисления +3 точно так же, как его соседи (но в главной подгруппе) бор (2s2 2p1) и алюминий (3s2 3p1). Другой пример: элемент побочной подгруппы марганец (Mn...4s2 3d5) может отдавать с валентной оболочки 7 электронов и иметь наибольшую степень окисления +7 точно так же, как находящиеся с ним в одной группе (но в главной подгруппе!) хлор, бром, иод. Но в I-й и особенно в VIII-й группах очень хорошо видно, насколько разные элементы собрались в главной и побочной подгруппах. Здесь действительно нет ничего общего между элементами главных и побочных подгрупп. Существует гораздо более удобная - так называемая “длинная” форма Периодической таблицы, где эти трудности устранены. Именно длинная форма Периодической таблицы рекомендована ИЮПАК (см. словарь терминов) к использованию во всем мире еще в 1989 году. Здесь нет подгрупп, а есть только группы. Идея этой таблицы ясна из рис. 4-4.
Рис. 4-4. Схема расположения s, p, d и f-элементов в длинной форме Периодической таблицы Вызовите из меню длинную форму Периодической таблицы и сравните ее с рис. 4-4. В длинной форме не восемь, а восемнадцать групп (и по правилам ИЮПАК они нумеруются не римскими, а арабскими цифрами). Десять d-элементов выделены в 10 самостоятельных групп. Вместе с двумя группами для s-элементов и шестью группами p-элементов общее количество групп составляет 18. В короткой форме таблицы только VIII групп - именно поэтому группы пришлось делить на подгруппы. Из-за большего числа групп в длинной форме таблицы ее периоды уже не нужно делить на ряды. Ряды существуют только в традиционной (короткой) форме таблицы Менделеева для того, чтобы поместить 18 элементов в VIII колонок (групп). Из-за d-элементов в короткой форме таблицы в каждом периоде (начиная с 3-го, где появляются d-элементы) - по два ряда. В длинной форме ряды оказываются не нужны - там каждый период состоит только из одной строчки. Длинная форма таблицы имеет еще одно важное достоинство - с ее помощью легко восстановить в памяти последовательность заполнения электронами уровней и подуровней в атомах элементов (это особенно важно на экзамене). Вместо того, чтобы запоминать уже известный нам ряд: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f» 6d,... можно по памяти начертить рис. 4-4 (это легче, чем может показаться на первый взгляд). В длинной форме таблицы все подуровни идут строго один за другим сверху вниз: под 1s мы видим 2s, 3s, и т.д.; под 2p мы видим 3p, 4p, и т.д.; под 3d мы видим 4d, 5d, и так далее. После этого сразу становится ясной последовательность заполнения всех электронных уровней любого элемента, даже еще не открытого. Нужно только помнить, что после 6s-подуровня заполняется 4f-подуровень, а после 7s-подуровня заполняется 5f-подуровень; f-элементы обычно выносят в отдельные строчки внизу таблицы, чтобы не делать ее “сверхдлинной” (такая таблица тоже существует и является наиболее строгой и логичной среди всех существующих форм Периодической таблицы, но она неудобна для печати). Кстати, из длинной формы таблицы и рис. 4-4 следует, что начиная со 113-го элемента наступит черед открытий элементов, заполняющих свой 7p-подуровень. Разумеется, длинная форма Периодической таблицы смогла появиться только после того, как выяснилось электронное строение атомов и стало понятно отличие d-элементов от s- и p-элементов. Несмотря на рекомендации ИЮПАК 1989 года, в России традиционно продолжают пользоваться короткой формой таблицы Д. И. Менделеева. Именно на нее ориентированы задания ЕГЭ и программы по химии. Только она (за редким исключением) до сих пор печатается в российских школьных учебниках. Разумеется, это неправильно и надо постепенно исправлять ситуацию. Но в любом случае полезно разбираться и в короткой форме Периодической таблицы, которая еще долго будет присутствовать в российском школьном образовании. Тем не менее, будущее, безусловно, за длинной формой Периодической таблицы.
|