Ньютоновские и неньютоновские жидкостиНьютоновскими называют жидкости, для которых вязкость не зависит от скорости деформации. В уравнении Навье — Стокса для ньютоновской жидкости имеет место аналогичный вышеприведённому закон вязкости (по сути, обобщение закона Ньютона, или закон Навье):
где σ i , j — тензор вязких напряжений. Среди неньютоновских жидкостей, по зависимости вязкости от скорости деформации различают псевдопластики и дилатантные жидкости. Моделью с ненулевым напряжением сдвига (действие вязкости подобно сухому трению) является модель Бингама. Если вязкость меняется с течением времени, жидкость называется тиксотропной. Для неньютоновских жидкостей методика измерения вязкости получает первостепенное значение. С повышением температуры вязкость многих жидкостей падает. Это объясняется тем, что кинетическая энергия каждой молекулы возрастает быстрее, чем потенциальная энергия взаимодействия между ними. Поэтому все смазки всегда стараются охладить, иначе это грозит простой утечкой через узлы.
Уравнение состояния реального газа Как вы знаете, модель идеального газа безотказно работает либо при высоких температурах, когда.хаотическое тепловое движение столь интенсивно, что молекулы движутся, не обращая внимания друг на друга, либо при малых плотностях, когда между молекулами слишком большие расстояния, чтобы они могли друг друга «чувствовать». При охлаждении или сжатии газа влияние молекулярного взаимодействия становится более заметным, и именно тогда газ может превратиться в жидкость. Таким образом, чтобы перекинуть мостик от газа к жидкости, надо уже в газе учесть существование сил молекулярного взаимодействия. Соответствующая модель носит название реального газа. Уравнение состояния реального газа проще всего получить, введя поправки на взаимодействие молекул в уравнение Менделеева — Клапейрона. Если расстояние между молекулами мало, они резко отталкиваются друг от друга. (Именно поэтому, например, трудно сжать жидкость.) Это легко понять, представив молекулы в виде бильярдных шаров, обладающих собственным объемом. Итак, первая поправка — на размеры молекул. Согласно уравнению идеального газа, объем V зависит от давления р по закону
где Т — абсолютная температура, R — универсальная газовая постоянная, а ν; — число молей газа. Значит, при очень большом давлении объем уменьшается практически до нуля. А бильярдные шары можно сжать лишь до некоторого минимального объема, который пропорционален их числу. Поэтому можно записать
Здесь b — константа, которая определяет суммарный объем всех «жестких» молекул, составляющих один моль данного газа (как показывают более точные расчеты, константа b равна учетверенному объему молекул). Теперь, как бы ни увеличивалось давление, объем моля газа никогда не станет меньше b. Мы учли еще не все проявления молекулярного взаимодействия. Как бильярдные шары сами по себе не собираются в большие группы, так и молекулы газа никогда не собрались бы вместе, чтобы «организовать» плотную жидкость, если бы они друг к другу не притягивались (на расстояниях больших, чем диаметр жесткого шара). Силы притяжения мешают молекулам разлететься и приводят к уменьшению давления по сравнению с тем, с которым газ действовал бы на стенки сосуда в их отсутствии. Обозначим это уменьшение давления через Δ р. Тогда получаем
Попытамеся оценить Δ р, полагая, что оно связано с изменением импульса (по сравнению со случаем отсутствия взаимодействия), передаваемого стенкам при ударе о них молекул газа. На подлетающие к стенкам молекулы действуют силы притяжения к остальным молекулам газа, направленные в глубь сосуда и уменьшающие поэтому их скорость. Эти силы, в первом приближении, пропорциональны плотности газа (при очень большом разрежении они вообще исчезают). Грубо можно считать, что и изменение импульса, передаваемого стенке при ударе одной молекулы, также пропорционально плотности. Но пропорционально плотности растет и среднее число ударов о стенки в единицу времени. Поэтому убыль давления Δ р оказывается обратно пропорциональной объему сосуда:
где a — постоянный для данного газа коэффициент. Окончательно уравнение состояния реального газа принимает вид:
или, как его обычно записывают,
Это — знаменитое уравнение Ван-дер-Ваальса, впервые увидевшее свет в 1873 году в работе ученого «О непрерывности газообразного и жидкого состояния» (Нобелевская премия 1910 года).» В теории Ван-дер-Ваальса каждый газ характеризуется своими параметрами а и b, которые можно определить из эксперимента. Приведем их значения для некоторых газов:
Но не в этом главное достижение теории. Построим несколько изотерм Ван-дер-Ваальса, отвечающих разным температурам (см. рисунок). При высоких температурах изотерма Ван-дер-Ваальса мало отличается от изотермы Бойля — Мариотта. С понижением температуры различие становится все более и более заметным; наконец, при некоторой температуре зависимость р (V) перестает быть монотонной. Образуется знаменитая «петля Ван-дер-Ваальса», когда при увеличении давления увеличивается и объем. Такого, конечно, быть не может. Появление петли показывает, что уравнение состояния реального газа перестает описывать действительную ситуацию. Это происходит как раз тогда, когда газ начинает превращаться в жидкость (реальная экспериментальная изотерма вместо петлеобразного участка содержит прямолинейный). Таким образом, получается, что газ может превратиться в жидкость лишь при температуре ниже некоторой определенной температуры, называемой критической, при которой петля появляется впервые. Оказывается, критическую температуру T k можно выразить через параметры a и b, характеризующие газ:
Теперь у нас достаточно информации, чтобы ответить на вопросы, заданные в самом начале. Рассчитаем, пользуясь данными таблицы, критические температуры водяного пара, азота и кислорода:
Все сразу становится ясным. Критические температуры азота и кислорода слишком низки, чтобы из этих газов при ночном охлаждении могла выпасть роса. Именно поэтому мы можем по утрам любоваться безобидными водяными каплями, а не спасаться от потоков жидкого азота и кислорода.
Фазовые переходы Фа́зовый перехо́д (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. С точки зрения движения системы по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и т. п.), фазовый переход происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе. Поскольку разделение на термодинамические фазы — более мелкая классификация состояний, чем разделение по агрегатным состояниямвещества, то далеко не каждый фазовый переход сопровождается сменой агрегатного состояния. Однако любая смена агрегатного состояния есть фазовый переход. Наиболее часто рассматриваются фазовые переходы при изменении температуры, но при постоянном давлении (как правило равном 1 атмосфере). Именно поэтому часто употребляют термины «точка» (а не линия) фазового перехода, температура плавления и т. д. Разумеется, фазовый переход может происходить и при изменении давления, и при постоянных температуре и давлении, но при изменении концентрации компонентов (например, появление кристалликов соли в растворе, который достиг насыщения).
|

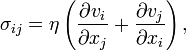
 ,
,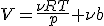 .
. .
. ,
,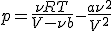 ,
,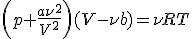 .
.
 .
. .
.


