Определение железа в растворе соли Мора.Определение содержания Fe2+ в растворах считают одним из важнейших применений перманганатометрии. Рассмотрим перманганатометрическое определение Fe2+ в растворе соли Мора, имеющей состав (NH4)2SO4 · FeSO4 · 6H2O или (NH4)2Fe(SO4)2 · 6H2O. При титровании перманганатом раствора этой соли в кислой среде происходит реакция
2KMnO + 10(NH4)2Fe(SO4)2 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + +(NH4)2SO4 + 8H2O,
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O, Fe2+ - e- → Fe3+. В данном случае молярная масса эквивалента соли Мора равна ее молярной массе. Поэтому и молярная масса эквивалента железа равна 55,85 г/моль. Ход определения. В мерную колбу вместимостью 100 мл возьмите для анализа немного раствора соли Мора, доведите объем его водой до метки и перемешайте. Ополосните полученным раствором пипетку, перенесите 10,00 мл его в коническую колбу, подкислите 8-10 мл 2 н. H2SO4 и титруйте раствором перманганата калия до появления бледно-розовой окраски, не исчезающей при встряхивании в течение 1-2 мин. Повторите титрование несколько раз, возьмите среднее из отсчетов и вычислите массу железа в анализируемом растворе. Допустим, что на титрование 10,00 мл раствора соли Мора пошло в среднем 12,50 мл 0,05181 н. раствора перманганата. Тогда нормальная концентрация раствора соли Мора
с = 0,05181 · 12,50/10,00 = 0,06476.
Умножив нормальную концентрацию на молярную массу эквивалента железа (55,85 г/моль), мы нашли бы содержание его в 1 л раствора. Но анализировались лишь 100 мл раствора. Содержание железа в них будет равно 0,06476 · 55,85 · 0,1 = 0,1615.
Раздел 4. Дихроматометическое титрование 4.1. Сущность дихроматометрического титрования. Дихроматометрическое титрование – один из методов окислительно-восстановительного титрования, основанный на использовании дихромата калия K2Cr2O7 в качестве окислителя. При действии на восстановители дихромат-ион Cr2O72- приобретает шесть электронов и восстанавливается до Cr3+ Cr2O72- + 6е- + 14Н+ → 2Cr3+ + 7Н2О. Следовательно, молярная масса эквивалента дихромата калия равна 1/6 молярной массы. Из уравнения реакции видно, что восстановление анионов Cr2O72- до катионов Cr3+ происходит в присутствии ионов Н+. Поэтому титруют дихроматом в кислой среде. Окислительно-восстановительный потенциал системы Cr2O72-→ 2Cr3+ составляет 1,36 В при [H+] = 1 моль/л. Следовательно, в кислой среде дихромат калия является сильным окислителем. Поэтому дихроматометрию успешно применяют для определения почти всех восстановителей, определяемых перманганатометрически. Дихроматометрия имеет даже некоторые преимущества перед перманганатометрией. Дихромат калия легко получить в химически чистом виде перекристаллизацией. Поэтому стандартный раствор K2Cr2O7 готовят растворением точной навески. Растворы дихромата калия чрезвычайно устойчивы при хранении в закрытых сосудах; он не разлагается даже при кипячении подкисленного раствора и практически не изменяется при стоянии раствора. Кроме того, дихромат калия труднее, чем перманганат, восстанавливается органическими веществами. Поэтому он не окисляет случайные примеси органических веществ. Этим также обусловливается постоянство его титра в растворе. Дихромат калия не окисляет (без нагревания) хлорид-ионы. Это позволяет титровать им восстановители в присутствии HCl. Индикатором при дихроматометрическом титровании чаще всего служит дифениламин, окрашивающий раствор в синий цвет при малейшем избытке дихромата. Дифениламин относится к группе так называемых редокс-индикаторов (окислительно-восстановительных индикаторов). Они представляют собой окислительно-восстановительные системы, изменяющие окраску при переходе восстановленной формы в окисленную или наоборот. Если обозначить окисленную форму индикатора Indокисл, восстановленную форму Indвосст, а число передаваемых электронов n, то превращение одной формы такого индикатора в другую можно изобразить схемой: Indокисл → Indвосст – n e- Каждый окислительно-восстановительный индикатор характеризуется определенным окислительно-восстановительным потенциалом. Для дифениламина он составляет +0,76 В. Окисленная форма дифениламина окрашена в синий цвет, а восстановленная форма бесцветна. К редокс-индикаторам кроме дифениламина относятся ферроин, дифениламиносульфонат натрия, фенилантрониловая кислота и др. Дихроматометрически определяют ионы Fe2+ в растворах HCl или в сернокислых растворах. Хлорид-ионы не мешают определению, если концентрация их не превышает 1 моль/л. Однако при титровании солей Fe2+ дихроматом в растворе накапливаются катионы Fe3+, окислительно-восстановительный потенциал системы Fe2+ → Fe3+ повышается и дифениламин окисляется. Поэтому синяя окраска может появиться, когда точка эквивалентности еще не достигнута. Чтобы понизить окислительно-восстановительный потенциал системы Fe2+ → Fe3+, к раствору кроме дифениламина и хлороводородной кислоты прибавляют еще ортофосфорную кислоту. Она маскирует мешающие ионы Fe3+, связывая их в прочный бесцветный комплекс Fe(HPO4)+. 4.2. Приготовление стандартного раствора дихромата калия. Стандартный раствор готовят растворением точной навески дихромата калия (х.ч.) в мерной колбе. Дихромат калия должен бытьпредварительно перекристализован из водного раствора и высушен при 1500 С. Приготовление 100 мл приблизительно 0,1 н. стандартного раствора дихромата калия. Выше было отмечено, что при взаимодействии с восстановителями в кислой среде дихромат-ион Возьмите маленькую пробирку около 0,5 г свежеперекристаллизованного дихромата калия и взвесьте на аналитических весах. С помощью воронки перенесите содержимое пробирки в мерную колбу вместимостью 100 мл. Снова взвесьте пробирку и по разности найдите массу навески. Растворите навеску дихромата калия в дистиллированной воде, уберите воронку и, пользуясь пипеткой, доведите объем раствора в колбе до метки. Вычислите титр и нормальную концентрацию раствора дихромата калия. Допустим, что навеска дихромата калия составила 0,4916 г. Тогда титр раствора
а нормальная концентрация
4.3. Определение содержания железа (II) в растворе. Дихроматометрическим методом железо определяют главным образом в рудах, сплавах, шлаках и других материалах. Однако при растворении их железо частично переходит в ионы Fe3+. Поэтому перед определением приходится восстанавливать Fe3+ до Fe2+. Достигается это действием металлов (или их амальгам), например действием металлического цинка: 2Fe3+ + Zn = 2 Fe2+ + Zn2+ Избыток цинка удаляют из раствора фильтрованием (например, через вату). Сущность реакции, используемой для дихроматометрического определения Fe2+, можно выразить уравнением
Определение состоит в прямом титровании анализируемого раствора стандартным раствором дихромата калия в присутствии дифениламина:
К исследуемому раствору прибавляют серную кислоту для поддержания высокой кислотности среды и фосфорную кислоту для связывания накапливающихся ионов Fe3+, которые могут преждевременно переводить дифениламин в окисленную (окрашенную) форму. Подготовка к анализу руды или сплава занимает очень много времени. Поэтому познакомимся только с дихроматометрическим определением Fe2+ в готовом растворе соли железа (II). Ход определения. В мерную колбу вместимостью 100 мл возьмите немного раствора, в котором все железо предварительно восстановлено до железа (II). Доведите объем раствора водой до метки и хорошо перемешайте. Ополосните полученным раствором пипетку, перенесите 10,00 мл его в коническую колбу, прибавьте 1-2 капли (не больше!) раствора дифениламина (раствор с массовой долей дифениламина 1 % в концентрированной серной кислоте, пл.1,84 г/см3), 3 мл ортофосфорной кислоты (пл.1,7 г/см3) и 5 мл разбавленной (1:4) серной кислоты. Титруйте полученную смесь из бюретки стандартным раствором дихромата калия до появления устойчивой (не исчезающей при встряхивании) сине-фиолетовой окраски раствора. Повторите титрование несколько раз и возьмите среднее из сходящихся отсчетов. Вычислите массу железа в анализируемом растворе. Допустим, что на титрование 10,00 мл раствора соли железа (II) расходовалось в среднем 8,25 мл 0,1003 н. раствора дихромата калия. Тогда нормальная концентрация соли с = 0,1003 Молярная масса эквивалента железа при дихроматометрическом титровании равна 55,85 г/моль. Поэтому масса Fe2+ в 0,1 л анализируемого раствора составит
В сельскохозяйственном анализе дихроматометрически определяют содержание Fe2+ в его солях, используемых как ядохимикаты.
Раздел 5. Методы осадительного титрования 5.1. Сущность осадительного титрования. Метод объединяет определения, основанные на реакциях образования осадков малорастворимых соединений. В этих целях пригодны только некоторые реакции, удовлетворяющие определенным условиям. Реакция должна протекать строго по уравнению и без побочных процессов. Образующийся осадок должен быть практически нерастворимым и выпадать достаточно быстро, без образования пересыщенных растворов. К тому же необходимо иметь возможность определять конечную точку титрования с помощью индикатора. Наконец, явления адсорбции (соосаждения) должны быть выражены при титровании настолько слабо, чтобы результат определения не искажался. Наименования отдельных методов осаждения происходят от названий применяемых титрантов. Метод, использующий раствор нитрата серебра, называют аргентометрией. Этим методом определяют содержание ионов Cl- и Br- в нейтральных и слабощелочных средах. Тиоцианометрия основана на применении раствора тиоционата аммония NH4SCN (или калия KSCN) и служит для определения следов Cl- и Br-, но уже в сильнощелочных и кислых растворах. Используют ее и для определения содержания серебра в рудах или сплавах. Дорогостоящий аргентометрический метод определения галогенов постепенно вытесняется меркурометрическим. В нем используют раствор нитрата ртути (I) Hg2(NO3)2. Рассмотрим более подробно аргентометрическое и тиоцианометрическое титрование.
5.2. Аргентометрическое титрование. Метод основан на реакции осаждения ионов Cl- и Br- катионами серебра с образованием малорастворимых галогенидов Cl- + Ag+ = AgCl↓, Br- + Ag+ = AgBr↓ При этом используют раствор нитрата серебра. Если же анализируют вещество на содержание серебра, то пользуются раствором хлорида натрия (или калия). Для понимания процесса аргентометрического титрования большое значение имеют кривые тирования. В качестве примера рассмотрим случай тирования 10,00 мл 0,1н. раствора хлорида натрия 0,1н. раствором нитрата серебра (без учета изменения объема раствора). До начала титрования концентрация хлорид-ионов в растворе равна общей концентрации хлорида натрия, т.е. 0,1 моль/л или [Cl-] = 10-1. Обозначив логарифм концентрации (или активности) определяемых хлорид-ионов через р функцию, можно написать pCl = -lg[Cl-] = -lg10-1 = 1. Когда к титруемому раствору хлорида натрия будет прибавлено 9,00 мл раствора нитрата серебра и 90% хлорид-ионов будут осаждены, концентрация их в растворе уменьшится в 10 раз и станет равна 1·10-2 моль/л, а pCl будет равна 2. Поскольку ПРAgCl = 10-10, концентрация ионов серебра при этом составит: [Ag+] = 10-10/[Cl-] = 10-10/10-2 = 10-8 моль/л, или pAg = -lg[Ag+] = −lg10-8 = 8. Аналогично вычисляют все остальные точки для построения кривой титрования. В точке эквивалентности pCl = pAg ≈ 5 (табл. 2).
Таблица 2. Изменение pCl и pAg при титровании 10,00 мл 0,1н. раствора хлорида натрия 0,1н. раствором нитрата серебра
На рисунке сплошная кривая показывает изменение pCl, а пунктирная – изменение pAg при титровании. На кривой титрования имеется резкий скачок изменения pCl от 4до 6 (или pAg от 6 до 4). Вследствие этого возможно фиксирование конечной точки аргентометрического титрования с помощью индикатора. Интервал скачка при аргентометрическом титровании зависит от концентрации растворов и от произведения растворимости осадка. Чем меньше величина произведения растворимости получающегося в результате титрования соединения, тем шире интервал скачка на кривой титрования и тем легче фиксировать конечную точку титрования с помощью индикатора. Наиболее распространено аргентометрическое определение хлора по методу Мора. Сущность его состоит в прямом титровании жидкости раствором нитрата серебра с индикатором хромата калия до побурения белого осадка. Индикатор метода Мора – раствор K2CrO4 дает с нитратом серебра красный осадок хромата серебра Ag2CrO4, но растворимость осадка (0,65·10-4 моль/ л) гораздо больше растворимости хлорида серебра (1,25∙10-5 моль/л). Поэтому при титровании раствором нитрата серебра в присутствии хромата калия красный осадок хромата серебра появляется лишь после добавления избытка ионов Ag+, когда все хлорид = ионы уже осаждены. При этом всегда к анализируемой жидкости приливают раствор нитрата серебра, а не наоборот. Возможности применения аргентометрии довольно ограничены. Ее используют только при титровании нейтральных или слабощелочных растворов (рН от 7 до 10). В кислой среде осадок хромата серебра растворяется. В сильнощелочных растворах нитрат серебра разлагается с выделением нерастворимого оксида Ag2O. Метод непригоден и для анализа растворов, содержащих ион NH4+, так как при этом образуется с катионом Ag+ аммиачный комплекс [Ag(NH3)2]+. Анализируемый раствор не должен содержать Ba2+, Sr2+, Pb2+, Bi3+ и других ионов, дающих осадки с хроматом калия. Тем не менее аргентометрия удобна при анализе бесцветных растворов, содержащих Cl-- и Br-- ионы. Растворы, содержащие Ag+, не выливают в раковину, а собирают в специальную склянку, так как серебро из них регенерируют.
|

 приобретает шесть электронов. Следовательно, молярная масса эквивалента K2Cr2O7 равна 294,20:6 = 49,03 г/моль и дляприготовления 0,1 л 0,1 н. раствора потребуется 49,03
приобретает шесть электронов. Следовательно, молярная масса эквивалента K2Cr2O7 равна 294,20:6 = 49,03 г/моль и дляприготовления 0,1 л 0,1 н. раствора потребуется 49,03  0,1
0,1 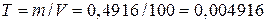 г/мл,
г/мл,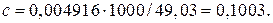

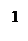
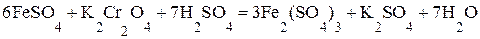
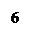

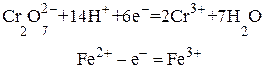
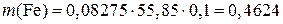 г.
г. 6
6
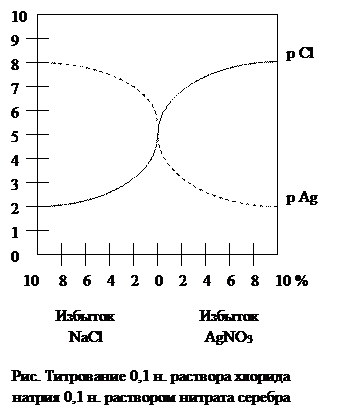 10-9
10-9



