Сущность метода.Комплексонометрическое титрование основано на реакциях, при которых определяемые ионы образуют комплексные соединения с некоторыми органическими соединениями. Если при этом получаются внутрикомплексные соединения – хелаты, как, например, с комплексонами, то имеет место комплексонометрическое (хеламетрическое) титрование. Комплексоны – это класс органических соединений – производных аминополикарбоновых кислот, из которых простейшей можно считать иминодиуксусную кислоту:
Наиболее распространены следующие комплексоны: нитрилотриуксусная кислота или комплексон I
;
этилендиаминтетрауксусная кислота или комплексон II
.
В практике технического и агрохимического анализа наиболее широко применяют динтариевую соль этилендиаминтетрауксусной кислоты − комплексон III
.
Комплексоны III образует со многими катионами достаточно прочные и растворимые в воде внутрикомплексные соли. Последние получаются в тех случаях, когда катион металла замещает атомы водорода функциональных групп органического соединения и одновременно взаимодействует с другими группами посредством координационной связи. Образование комплексоном III внутрикомплексного соединения с каким-нибудь двухзарядным катионом происходит путем замещения металлом атомов водорода карбоксильных групп и одновременного взаимодействия катиона с атомами азота аминогрупп (за счет координационной связи)
.
Сплошными линиями здесь показаны обычные связи, а стрелками − координационные. Комплексон III получил широкое применение в химическом анализе, потому что он образует внутрикомплексные соли с катионами щелочно-земельных металлов (Ca2+, Mg2+, Ba2+), которые очень трудно перевести в комплексные соединения другими способами. Титрование комплексоном III используют для количественного определения этих катионов. Разумеется, при этом приходится устанавливать точку эквивалентности с помощью индикаторов.
6.2. Индикаторы хелатометрического титрования Точку эквивалентности при хелатометрическом титровании определяют несколькими способами. Реакции комплексообразования сопровождаются обычно выделением ионов водорода в количестве эквивалентном катионам. Ионы водорода можно определить алкалиметрически с одним из кислотно-основных индикаторов. Иногда точку эквивалентности хелатометрического титрования определяют физико-химическими методами. Но чаще всего используют индикаторы-комплексообразователи, т.е. органические красители, образующие с катионами окрашенные комплексные соединения (так называемые металл-индикаторы). Например, катионы кальция, магния (и некоторые другие) дают с такими индикаторами внутрикомплексные соединения красного цвета. Эти соединения, однако, менее прочны, чем комплексы тех же катионов с комплексоном III. Поэтому при титровании анализируемого раствора комплексоном III ионы металла переходят от индикатора к комплексону, и выделяется свободный ион индикатора, имеющий синюю окраску. Таким образом, в точке эквивалентности красная окраска раствора сменяется синей. В настоящее время для хелатометрического титрования используют главным образом индикаторы: хромоген черный специальный ЕТ-00 (С20Н13О7N3S) и мурексид (С8Н6N6О6). Хромоген черный специальный ЕТ-00. Анион этого красителя, обозначаемый через Hind2+, имеет в щелочной среде (рН 11,5) синюю окраску. С катионами двухвалентных металлов (магния и других) он образует комплексы винно-красного цвета Me2+ + Hind2- = MeInd + H+ синий винно- красный При последующем титровании комплексоном III эти комплексы разрушаются: ионы металла связываются комплексоном в более прочные (менее диссоциирующие) комплексные соединения, а анионы индикатора переходят в раствор, сообщая ему синюю окраску: MeInd- + [H2Y]2- = [MeY]2- + Hind2- + H+ винно- бесцвет- бесцвет- синий красный ный ный
В результате этого винно-красная окраска раствора сменяется синей. Наиболее четко она изменяется в щелочной среде при рН 8-10. Поэтому к титруемому раствору добавляют аммонийную буферную смесь (NH4OH + NH4Cl), которая поддерживает заданное значение рН. Переход окраски считают не менее четким, чем в случае кислотно-основных индикаторов. Обычно 0,5 г хромогена черного растворяют в 19 мл аммонийного буферного раствора и доводят объем жидкости этиловым спиртом до 100 мл. Однако спиртовой раствор индикатора не очень стоек. Поэтому вместо него часто пользуются сухой смесью 1 г хромогена черного со 100 г (или 200 г) индифферентного наполнителя, например химически чистого хлорида натрия. Смесь тщательно растирают в фарфоровой ступке. Перед титрованием вносят в раствор 20-30 мг этой смеси на конце шпателя. Мурексид – аммонийная соль пурпурной кислоты. Анион этого индикатора Ind- взаимодействует в щелочной среде с двухзарядными катионами некоторых металлов по схеме: Me2+ + Ind- = MeInd+ сине- красный фиолетовый Комплексы металлов с мурексидом, окрашенные в интенсивно-красный цвет, также менее устойчивы, чем аналогичные комплексы с комплексоном III. Поэтому при титровании катионы связываются комплексоном, а анионы индикатора освобождаются и сообщают раствору сине-фиолетовую окраску (при рН > 10,9): MeInd+ + [H2Y]2 = [MeY]2- + Ind- + 2H+ красный бесцвет- бесцвет- сине- ный ный фиолетовый Мурексид используют для хелатометрического определения ионов кальция, никеля и меди. Комплексы мурексида с ионами бария и магния очень нестойки. При определении кальция титруемый раствор сильно подщелачивают гидроксидом натрия до рН не менее 12. Индикатором служит свежеприготовленный насыщенный водный раствор мурексида. Иногда вместо не очень устойчивого раствора пользуются твердой смесью мурексида с хлоридом натрия (х.ч.) в соотношении 1:100 (по массе). Для титрования иногда используют другие индикаторы: пирокатехиновый фиолетовый (ПФ), ксиленовый оранжевый (КО), кислотный хром синий К, сульфосалициловую кислоту и др.
6.3. Способы хелатометрического титрования Существует несколько способов хелатометрического титрования: прямое и обратное титрование, титрование заместителя. Прямое титрование. Анализируемый раствор разбавляют в мерной колбе водой до метки и берут для титрования определенную (аликвотную) часть пипеткой. Титруют в щелочной среде при рН ≈ 10; это значение рН поддерживают при помощи аммонийной буферной смеси. Для титрования используют стандартный раствор комплексона III. Индикаторами служат хромоген черный специальный ЕТ-00 или мурексид. При прямом титровании комплексоном III концентрация определяемого катиона сначала понижается постепенно, но вблизи точки эквивалентности падает очень резко. Это позволяет определять конечную точку титрования по мгновенному изменению окраски индикатора. Прямое титрование комплексоном III применяют для определения катионов магния, кальция, стронция, бария, цинка, кобальта (II), никеля(II), меди(II), железа (III) и некоторых других. Обратное титрование используют, когда прямое титрование невозможно по тем или иным причинам, например, если для определяемого катиона нет подходящего индикатора или комплексообразование протекает слишком медленно. К анализируемому раствору прибавляют определенный объем стандартного раствора комплексона III, нагревают смесь для завершения реакции, охлаждают и оттитровывают избытком комплексона точный раствор сульфата магния. Конечную точку титрования определяют при помощи индикатора, реагирующего на ионы магния. Титрование заместителя основано на том, что ионы магния образуют с комплексоном III менее устойчивый комплекс, чем большинство других катионов. Поэтому при смешении катионов определяемого металла (например, кальция) с магниевым комплексом комплексона происходит обменная реакция Ca2+ + Na2[MgY] Поскольку комплекс иона Ca2+ с комплексоном устойчивее аналогичного комплекса магния, равновесие реакции смещается вправо. Выделившиеся ионы магния, т.е. заместители кальция, оттитровывают комплексоном III в присутствии хромогена черного. Вычисляют содержание катионов кальция в растворе.
6.4. Определение общей жесткости воды В практике агрохимического анализа хелатометрическое титрование применяют для определения общей жесткости природных вод, которую характеризуют молярной концентрацией эквивалентов кальция и магния и выражают в моль/л. Анализируемую воду подщелачивают аммонийной буферной смесью до рН
винно-красный вино-красный Константы устойчивости этих комплексов равны соответственно
винно-красный синий
винно-красный синий В эквивалентной точке винно-красная окраска раствора сменяется синей вследствие накопления анионов индикатора. Необходимую для определения аммонийную буферную смесь приготовляют в мерной колбе вместимостью 1000 мл, смешивая 100 мл раствора хлорида аммония с массовой долей Обычно природную воду титруют 0,05 н раствором комплексона III. Раствор приготовляют из точной навески химически чистого препарата, учитывая, что формула комплексона III Ход определения. В колбу для титрования отмерьте пипеткой 100,0 мл исследуемой воды и прилейте 5 мл аммонийной буферной смеси. Прибавляйте по каплям раствор индикатора (хромогена черного) до появления хорошо заметной, но не очень темной винно-красной окраски (вместо этого можно внести на конце шпателя 20-30 мг сухой смеси индикатора с хлоридом натрия). Титруйте воду 0,05 н раствором комплексона III до перехода вино-красной окраски в синюю. В конце титрования раствор комплексона прибавляйте по одной капле, добейтесь, чтобы красноватый оттенок совершенно исчез. Повторите титрование 2-3 раза и из сходящихся отсчетов возьмите среднее. Общую жесткость воды (Са2+ и Мg2+ на 1 л) вычислите по формуле в моль/л: Ж = Где с – нормальная концентрация раствора комплексона III (число эквивалентности Z = 2); Например, на титрование 100,0 мл природной воды пошло в среднем 17,60 мл 0,5022 н раствора комплексона. Тогда Ж
6.5. Определение примесей магния в калийных удобрениях Хелатометрическим титрованием определяют содержание примесей магния в калийных удобрениях, например в сульфате калия или в калийной соли. Технический сульфат калия – это продукт переработки каинитосильвинитовой руды. По техническим условиям он должен содержать не более 1% оксида магния. Калийная соль смешанная 30% представляет собой смесь хлорида калия, природного сильвинита и каинита. В ней в пересчете на MgO массовых долей Mg от 1,0 до 1,5%. Калийные удобрения практически не содержат кальция. Поэтому определение магния в них возможно прямым титрованием водных растворов комплексоном III в присутствии хромогена черного специального. Вместо калийных удобрений для анализа могут быть выданы образцы искусственных смесей хлоридов (или сульфатов) калия и магния с различной массовой долей последнего. Ход определения. Из образца калийного удобрения возьмите на технохимических весах навеску в 2,50 г, перенесите в стакан вместимостью 250 мл, прибавьте 50-75 мл воды, хорошо перемешайте, осторожно нагрейте на электроплитке и кипятите до полного растворения. Дайте раствору остыть, перенесите его в мерную колбу вместимостью 250 мл, доведите водой до метки, перемешайте. Если раствор будет мутным, то часть его отфильтруйте и используйте для определения. Перенесите пипеткой 25 мл полученного раствора в колбу для титрования, разбавьте водой приблизительно до 100 мл, прибавьте 10 мл аммонийно-буферной смеси и 7-10 капель свежеприготовленного индикатора хромогена черного (до винно-красной окраски). Затем медленно титруйте смесь 0,05 н. раствором комплексона III до перехода винно-красной окраски в синюю. Изменение окраски раствора хорошо заметно на белом фоне. Повторите титрование 2-3 раза и из сходящихся отсчетов возьмите среднее. Число моль эквивалентов магния в 1 л раствора вычислите по формуле n (Mg2+) = c V/V 1, где с – нормальная концентрация раствора комплексона III; V − объем рабочего раствора комплексона, затраченный на титрование, мл; V 1 – объем раствора удобрения, взятый для титрования (в данном случае 25,0 мл). Содержание магния в калийных удобрениях принято пересчитывать на оксид магния. Для вычисления массы оксида магния в навеске удобрения воспользуйтесь формулой m (MgO)= n (Mg2+) ЭV, где Э – молярная масса эквивалента оксида магния (20,16 г/моль); V – объем раствора удобрения (0,25 л). Выразите содержание оксида магния в массовых долях (%).
Раздел 7. Контрольные вопросы и задачи 1. В чем отличия титриметрического анализа от гравиметрического? 2. Что такое точка эквивалентности, конечная точка титрования? 3. Что такое скачок титрования? 4. Приведите классификацию методов титриметрии по типу химической реакции и по способу титрования. 5. Перечислите основные требования, предъявляемые к реакциям в титриметрии. 6. Что такое кривая титрования? В каких координатах строят кривую титрования в методе: а) кислотно-основного титрования; б) окислительно-восстановительного титрования; в) комплексометрического титрования; г) осадительного титрования? 7. Чему равны молярные массы эквивалентов H2SO4, H2SO3, Mg(OH)2 и Ва(OH)2 в реакциях полной нейтрализации и в реакциях неполной нейтрализации? 8. Что такое титр раствора? Какова масса HNO3, содержащаяся в 500 мл раствора, если титр его равен 0,006300 г/мл? 9. Титр раствора HCl равен 0,003592 г/мл. Вычислите его нормальную концентрацию. 10. На титрование 20,00 мл раствора HNO3 затрачено 15,00 мл 0,1200 н. раствора NaOH, вычислите нормальную концентрацию, титр и массу азотной кислоты в 250 мл раствора. 11. Какой объем 0,1500 н. раствора NaOH пойдет на титрование 21,00 мл 0,1133 н. раствора HCl? 12. Какова нормальная концентрация раствора H2C2O4 · 2H2O, полученного растворением 1,7334 г ее в мерной колбе вместимостью 250 мл? 13. Что такое стандартные и стандартизированные растворы? Каковы требования, предъявляемые к исходным стандартным веществам для установки нормальной концентрации раствора? 14. Стандартизацию раствора HCl можно сделать по титрованному раствору NaOH и по Na2B4O7 · 10H2O. Какой из этих способов обеспечит более высокую точность и почему? 15. Почему раствор щелочи не должен содержать карбонат-ион? Назовите способ приготовления раствора щелочи, не содержащего карбонат-ион? 16. Почему, устанавливая титр раствора, пользуются той же мерной посудой, что и при выполнении самого определения? 17. Какой смысл заключен в выражениях Т(HCl/Na2CO3) и T(Na2CO3/HCl)? В граммах каких веществ выражен каждый из этих титров? 18. Какие из перечисленных растворов а) HCl; б) NaOH; в) Na2CO3; г) Na2B4O7; д) Н2С2О4 – являются стандартными (исходными), а какие стандартизированными (рабочими)? 19. Назвать исходные вещества для стандартизации растворов: а) HCl; б) NaOH. Привести уравнения реакций взаимодействия этих веществ со стандартизируемыми растворами и определить молярную массу эквивалентов. 20. Какой из индикаторов (метиловый оранжевый, фенолфталеин, лакмус) пригоден для титрования: а) HNO3 + NaOH; б) NH3 + HCl; в) Na2CO3 + HCl; г) HCOOH + NaOH? 21. В чем сущность перманганатометрического титрования? Почему обычно не нужен индикатор при перманганатометрических определениях? 22. Чему равны молярные массы эквивалентов окислителей и восстановителей в следующих реакциях 2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O, 2KMnO4 +3MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4, K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 3I2 + 4K2SO4 +7H2O. 23. Навеску KMnO4 1,8750 г растворили и довели объем раствора водой до 500 мл. Вычислите нормальную концентрацию раствора для реакции а) в кислой среде; б) в щелочной среде. 24. На чем основано дихроматометрическое титрование восстановителей? 25. Чему равна молярная масса эквивалента дихромата калия при взаимодействии его с железом (II)? 26. В чем преимущества дихромата калия перед перманганатом калия? 27. В чем дихроматометрическое титрование уступает перманганатометрическому? 28. Что такое редокс-индикаторы? 29. Как производят хроматометрическое определение железа (II)? Что при этом служит индикатором? Зачем к раствору прибавляют ортофосфорную кислоту? 30. В чем сущность метода Мора? Каковы условия его применения? 31. На чем основан применение хромата калия в качестве индикатора при титровании хлоридов по методу Мора? 32. В чем состоят особенности титрования по методу Фольгарда? Какой индикатор при этом применяют? 33. Изложите сущность метода комплексонометрии. 34. Объясните сущность прямого, обратного и заместительного приемов комплексонометрического титрования. В каких случаях применяется каждый из названных приемов? 35. Что такое металлохромные индикаторы? Назовите важнейшие из них.
Список литературы
1. Васильев В.П. Аналитическая химия. В 2 ч. Ч. 1. Гравиметрический и титриметрический методы анализа: Учеб. для химико-технол. спец. вузов. – М.: Высш. шк., 1989. 320 с.: ил. 2. В.П. Васильев. Практикум по аналитической химии. Учебное пособие для вузов. – М.: Химия. 2000. – 328 с.: ил. 3. Основы аналитической химии. Кн. 2. Методы химического анализа: Учеб. для вузов/ Под ред. Ю.А. Золотова. – 2-е изд., перераб. и доп. – М.: Высш. шк.: 2000. – 494 с.: ил. 4. И.К. Цитович. Курс аналитической химии. Учебник. 8-е изд., стер. – СПб.: Издательство «Лань». 2004. – 496 с.: ил.
Веденеева Л.Н., Крепышева И.В.
|

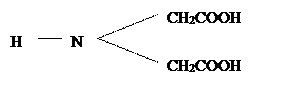
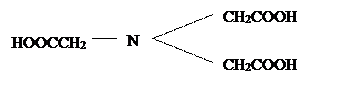
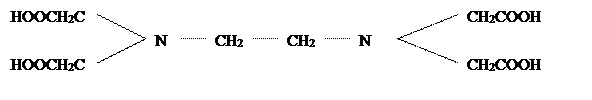
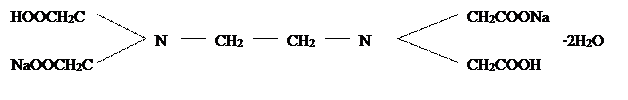
 Это соединение (иногда называемое трилоном Б) обозначают сокращенной формулой Na2H2Y или ЭДТА. Комплексон III содержит наряду с карбоксильными группами СООН еще и третичные аминогруппы N. Поэтому он считается не только органической кислотой, дающей соли с различными катионами, но также и комплексообразующим веществом.
Это соединение (иногда называемое трилоном Б) обозначают сокращенной формулой Na2H2Y или ЭДТА. Комплексон III содержит наряду с карбоксильными группами СООН еще и третичные аминогруппы N. Поэтому он считается не только органической кислотой, дающей соли с различными катионами, но также и комплексообразующим веществом.
 Na2[CaY] + Mg2+.
Na2[CaY] + Mg2+. 10. Индикатором служит обычно хромоген черный специальный ЕТ-00, образующий с ионами Са2+ и Мg2+ растворимые комплексы вино-красного цвета:
10. Индикатором служит обычно хромоген черный специальный ЕТ-00, образующий с ионами Са2+ и Мg2+ растворимые комплексы вино-красного цвета: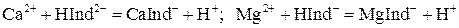
 и
и  . Но константы устойчивости комплексов Са2+ и Мg2+ с комплексоном III гораздо больше (
. Но константы устойчивости комплексов Са2+ и Мg2+ с комплексоном III гораздо больше (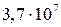 и
и 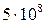 ). Поэтому при титровании комплексы металлов с индикатором разрушаются и образуются более прочные комплексы с комплексоном III (при рН 10):
). Поэтому при титровании комплексы металлов с индикатором разрушаются и образуются более прочные комплексы с комплексоном III (при рН 10):

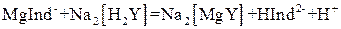
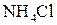 20% со 100 мл раствора аммиака с массовой долей
20% со 100 мл раствора аммиака с массовой долей 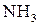 20% и доводя объем смеси водой до метки.
20% и доводя объем смеси водой до метки.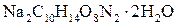 , а молярная масса эквивалента его в данной реакции равна половине полярной массы (Z = 2). Иногда нормальную концентрацию раствора комплексона устанавливают по 0,05 н раствору сульфата магния
, а молярная масса эквивалента его в данной реакции равна половине полярной массы (Z = 2). Иногда нормальную концентрацию раствора комплексона устанавливают по 0,05 н раствору сульфата магния 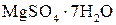 , приготовленному из фиксанала (или по хлориду кальция).
, приготовленному из фиксанала (или по хлориду кальция).
 - объем рабочего раствора комплексона, затраченный на титрование, мл;
- объем рабочего раствора комплексона, затраченный на титрование, мл;  - объем воды (мл), взятый для определения.
- объем воды (мл), взятый для определения.



