ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИЗаконы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики. Скорость химической реакции определяется как изменение концентрации одного из реагирующих веществ или продуктов реакции в единицу времени. Среднюю скорость реакции в промежутке времени от t1 до t2 рассчитывают следующим образом:
где с1 и с2 – концентрация вещества в моменты времени t1 и t2 соответственно. Знак плюс берется при расчете скорости по продукту реакции, в ходе реакции концентрация продукта возрастает, с2 > с1, Dс>0. Знак минус берется при расчете скорости по одному из исходных реагентов, концентрация его при протекании реакции убывает, с2 < с1, Dс<0. Мгновенная скорость, т.е. скорость реакции в данный момент времени и соответственно при данной концентрации с, есть Значение концентрации в выражении для скорости берется в моль/м3 либо в моль/дм3 (моль/л), время – в секундах, минутах, часах. Для всякой химической реакции зависимость скорости реакции от концентраций реагирующих веществ выражается законом действующих масс:
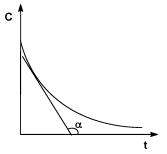
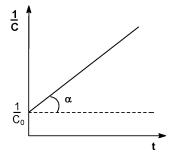
где Сi – концентрация i-го реагента. Показатель степени при концентрации называется порядком реакции по i-му веществу. Для простых реакций показатель степени совпадает со стехиометрическим коэффициентом в уравнении реакции. Коэффициент пропорциональности k в законе действующих масс называется константой скорости. Константа скорости химической реакции является характеристикой каждой конкретной реакции, зависит от температуры и не зависит от концентраций. Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рис. 1) Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
Коэффициент пропорциональности к (в уравнении 3), есть константа скорости химической реакции Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л. Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции, есть частный порядок реакции по данному компоненту Сумма показателей степени в кинетическом уравнении химической реакции представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени. В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
Реакции нулевого порядка Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ, это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения. Уравнение зависимости концентрации от времени: Еще одной кинетической характеристикой реакции является период полупревращения или период полураспада – это время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Для реакции нулевого порядка, учитывая, что С = ½ С0 Период полураспада:
Реакции первого порядка Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А → В. Реакции первого порядка характеризуются кинетическим уравнением вида: Уравнение зависимости концентрации от времени:
Период полураспада:
Реакции второго порядка Для реакций второго порядка кинетическое уравнение имеет следующий вид:
Уравнение зависимости концентрации от времени: Период полураспада:
Таблица 1 Кинетические уравнения реакций первого, второго и нулевого порядка
Порядок химической реакции есть формально-кинетическое понятие, физический смысл которого для элементарных (одностадийных) реакций заключается в следующем: порядок реакции равен числу одновременно изменяющихся концентраций. В случае элементарных реакций порядок реакции может быть равен сумме коэффициентов в стехиометрическом уравнении реакции: однако в общем случае порядок реакции определяется только из экспериментальных данных и зависит от условий проведения реакции.
Молекулярность элементарных реакции Элементарными (простыми) называют реакции, идущие в одну стадию Их принято классифицировать по молекулярности – числу частиц которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия. Мономолекулярные - реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.): Бимолекулярные - реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных): Тримолекулярные - реакции, элементарный акт которых осуществляется при столкновении трех частиц: Реакции с молекулярностью более трех неизвестны. Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совладают. Тем не менее, никакой четко определенной взаимосвязи между понятиями молекулярности и порядка реакции не существует, поскольку порядок реакции характеризует кинетическое уравнение реакции, а молекулярность – механизм реакции. Цель работы: Определить константу скорости реакции окисления иодид-ионов пероксидом водорода в кислой среде двумя способами. Реактивы: раствор H2SO4, 2н раствор H2O2, 0,05 н раствор Na2S2O3, 0,05 н раствор KI, 0,4 %-ный (либо другой концентрации, по указанию преподавателя) раствор крахмала 0,5 %-ный (индикатор) раствор молибдата аммония (NH4)2MoO4 (катализатор) Оборудование и посуда: коническая колба на 250 мл пипетки на 100 мл, 10 мл, 5 мл бюретка 25 мл секундомер термометр Выполнение работы: Изучаемая в данной работе реакция окисления иодид-ионов пероксидом водорода в водном растворе в кислой среде протекает по уравнению: H2O2 + 2I– + 2H+ = I2 + 2H2O (1) Механизм реакции сложный, включает несколько стадий. В целом в реакции участвуют три вида частиц, и в реакционной смеси могут изменяться концентрации всех этих частиц, влияя на скорость реакции. При избытке кислоты (ионов H+) концентрация [H+] может считаться постоянной. Концентрацию иодид-ионов [I–] можно поддерживать постоянной. Для этого в ходе опыта к реакционной смеси периодически добавляют одинаковые количества тиосульфата натрия Na2S2O3. Тиосульфат реагирует с выделяющимся при реакции (1) иодом по уравнению I2 + 2S2O32– = 2I– + S4O62– (2) Таким образом, пероксид водорода расходуется в реакции, а концентрация иодид-ионов остается практически постоянной. Кинетическое уравнение реакции окисления
где
В коническую колбу наливают пипеткой (мерной колбой) 100 мл раствора KI и пипеткой 5 мл раствора H2SO4. Бюретку заполняют раствором тиосульфата натрия. В течение опыта раствор тиосульфата в бюретку не добавлюят! В колбу с подкисленным раствором иодида из бюретки добавляют точно 1 мл раствора тиосульфата. Приливают 5 капель раствора крахмала. В эту же колбу наливают пипеткой 10-20 мл пероксида водорода, тщательно перемешивают и ставят под бюретку с тиосульфатом. В момент окрашивания реакционной смеси в синий цвет включают секундомер. Немедленно добавляют еще 1 мл тиосульфата и перемешивают, окраска раствора исчезает. Отмечают момент следующего окрашивания раствора (секундомер не выключать!), сразу добавляют следующий мл раствора тиосульфата. Записывают время появления окрашивания по секундомеру. Продолжают наблюдение, производят до 10 отсчетов по секундомеру, соответствующих окрашиванию реакционной смеси, каждый раз приливая по 1 мл раствора тиосульфата. Затем добавляют 3-5 капель раствора молибдата аммония в качестве катализатора. Реакция проходит до конца, т.е. весь пероксид водорода вступает в нее. Выделившийся при этом иод оттитровывают тиосульфатом до исчезновения окраски. Записывают окончательный (общий) объем тиосульфата V0. Общее количество Na2S2O3 эквивалентно начальному количеству H2O2.
|

 , (1)
, (1) (2)
(2) , (3)
, (3)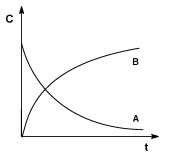
 (4)
(4) (5)
(5) (6)
(6) (7)
(7) (8) или
(8) или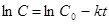 (9)
(9) (10)
(10)
 (11) или
(11) или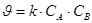 (12)
(12) (13)
(13)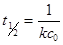 (14)
(14)
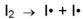


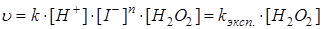 ,
, есть величина постоянная при соблюдении вышеуказанных условий, n – порядок реакции по I–. kэксп – экспериментально наблюдаемая константа скорости реакции первого порядка по пероксиду водорода.
есть величина постоянная при соблюдении вышеуказанных условий, n – порядок реакции по I–. kэксп – экспериментально наблюдаемая константа скорости реакции первого порядка по пероксиду водорода.


