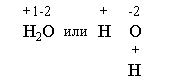Окислительно-восстановительные свойства элементов. Степень окисления.Передача электронов от атома к атому называется окислением-восстановлением. Окисляется тот атом, который отдает свои электроны, а принимающий электроны - восстанавливается. Если в результате реакции получается ионное соединение, то положительно заряженный ион образовался из того элемента, который отдал свои электроны, а отрицательный ион - из элемента, который электроны принял. Например, натрий активно взаимодействует с хлором (внешне это напоминает горение с выделением белого дыма - очень мелких кристаллов NaCl). В образовавшейся соли Na+Cl– натрий заряжен положительно, а хлор отрицательно. Следовательно, натрий окислился, а хлор - восстановился. Чуть позже мы объясним, как легче запомнить новые термины. Благодаря передаче электронов от атома к атому многие ионы, образующиеся в таких реакциях, имеют электронную конфигурацию инертных газов. Приобретение устойчивых “завершенных” оболочек дает большой выигрыш в энергии. Такие одинаковые электронные оболочки ионов называются изоэлектронными. В первой части таблицы 3-4 собраны ионы, изоэлектронные атому неона (он поставлен первым), в другой части таблицы - ионы, изоэлектронные атому аргона. Рядом с каждой частицей указана ее степень окисления. Что это такое? Таблица 3-4. Ионы, находящиеся в каждой вертикальной колонке, имеют одинаковое электронное строение, совпадающее с электронной оболочкой одного из инертных газов.
При образовании химических связей между атомами электроны частично передаются от менее электроноакцепторных атомов к более электроноакцепторным атомам. Количество отданных или принятых атомом электронов называется степенью окисления атома в молекуле. При связывании разных атомов степень окисления равна заряду, который приобрел бы атом в этом соединении, если бы оно могло состоять из ионов. Довольно просто определять степень окисления в ионных соединениях, где сразу видно, откуда и куда перешли электроны. Из табл. 3-4 видно, что знак и величина степени окисления всегда совпадают со знаком и зарядом одноатомных ионов. Например, при взаимодействии магния с кислородом образуется ионное соединение Mg2+O2- (где 2+ и 2- заряды ионов магния и кислорода, табл. 3-4). Степень окисления магния составляет +2, а степень окисления кислорода составляет -2. Точно так же в соединении CaCl2 степень окисления кальция +2, а степень окисления хлора -1. Сложнее обстоит дело с полярными ковалентными соединениями. Здесь на помощь приходит знание относительной электроотрицательности элементов. Например, в молекуле воды Н2О кислород более электроотрицателен, чем водород (см. таблицу 3-3). Значит, электроны связей смещены в сторону кислорода. Если бы вода была ионным соединением, то ее формулу можно было бы записать так:
Здесь степени окисления - это условные заряды атомов в молекуле, если считать, будто бы это ионная, а не полярная ковалентная молекула. Тогда степень окисления кислорода в воде составляет -2, а степень окисления водорода +1. Кому-то из вас может показаться, что степень окисления - это та же валентность, но только со знаком "+" или "-". На самом деле это не всегда верно. Давайте посчитаем степень окисления в другом соединении водорода и кислорода - перекиси водорода Н2О2. Структурная и гипотетическая “ионная” формулы этого вещества выглядят так:
Второй заряд "-" не может появиться на атоме кислорода потому, что кислород не в состоянии оттянуть электроны от такого же точно атома кислорода вдоль связи О—О. Вывод: степень окисления кислорода в этом соединении составляет -1 (хотя его валентность по-прежнему II). Степень окисления водорода составляет +1. Степень окисления и валентность несут разную информацию об атоме в его соединениях. Валентность просто характеризует способность атома образовывать некоторое количество химических связей, а степень окисления описывает смещения электронов при образовании химических связей. Итак, уточним определение степени окисления с учетом всего того, что было сказано о ковалентных соединениях:
|