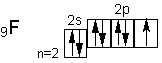Пероксид водорода. Пероксид водорода (перекись водорода) Н2О2 — тяжелая полярная жидкость голубоватого цвета, строение которой показано на .Пероксид водорода (перекись водорода) Н2О2 — тяжелая полярная жидкость голубоватого цвета, строение которой показано на В жидком состоянии молекулы пероксида водорода сильно ассоциированы благодаря водородным связям. Поскольку пероксидводорода имеет больше возможностей к образованию таких связей (ввиду большего числа атомов кислорода на один атом водорода),чем вода, то он имеет большие плотность, вязкость и температуру кипения (150,2°С). Пероксид водорода смешивается с водой во всех отношениях, чистый Н2О2 и весьма концентрированные растворы взрываются на свету; 30%-ный раствор пероксида водорода в воде имеет техническое название «пергидроль». Пероксид водорода каталитически разлагается при комнатной температуре, выделяя в первый момент атомарный кислород. На этом основано использование 3%-ного раствора Н2О2 в медицине. Пероксид водорода вступает в реакции трех типов: без изменения пероксидной группировки: Ва(ОН)2 + Н2О2 = ВаО2 + 2Н2О, в качестве восстановителя: 2KMnО4 + 5Н2О2 + ЗН2SО4 = 2MnSО4 + К2SО4 + 5О2 + 8Н2O, и, что более характерно, в качестве окислителя: РbS + 4Н2О2 = PbSO4 + 4Н2О В лаборатории пероксид водорода получают действием разбавленной серной кислоты на пероксид бария: ВаО2 + Н2SО4 = ВаSО4↓+ Н2О2. Пероксид водорода имеет разнообразное применение: для получения отбеливателей, вводимых в синтетические моющие средства; для получения различных пероксидов,особенно в органической химии; в реакциях полимеризации; для получения антисептических средств; для реставрации живописи на основе свинцовых красок. · Галогены · Общая характеристика · В подгруппу галогенов входят фтор, хлор, бром, иод и астат (астат - радиоактивный элемент, изучен мало). Это р-элементы VII группы периодической системы Д.И. Менделеева.На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5. Этим объясняется общность их свойств. · Свойства элементов подгруппы галогенов
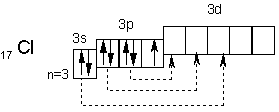
· Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами. · Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления: +1, +3, +5, +7. Возможные значениястепеней окисления объясняются электронным строением, которое у атомов фтора можно представитьсхемой · · Будучи наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2р-подуровень.У него один неспаренный электрон, поэтому фтор бывает только одновалентным, а степень окисления всегда -1. · Электронное строение атома хлора выражается схемой · · У атома хлора один неспаренный электрон на 3р-подуровне и обычном (невозбужденном) состоянии хлор одновалентен. Но поскольку хлор находится в третьем периоде,то у него имеется еще пять орбиталей 3d-подуровня, в которых могут разместиться 10 электронов. · В возбужденном состоянии атома хлора электроны переходят с 3p - и 3s-подуровней на 3d-подуровень (на схеме показано стрелками). Разъединение (распаривание)электронов, находящихся в одной орбитали, увеличивает валентность на две единицы. Очевидно, хлор и его аналоги (кроме фтора) могут проявлять лишь нечетную переменную валентность 1, 3, 5, 7 и соответствующие положительные степени окисления. У фтора нет свободных орбиталей, а значит, при химическихреакциях не происходит разъединения спаренных электронов в атоме. Поэтому при рассмотрении свойств галогенов всегда надо учитывать особенности фтора и соединений. · Водные растворы водородных соединений галогенов являются кислотами: НF — фтороводородная (плавиковая), НСl — хлороводородная (соляная), НВr — бромводородная,НI — йодоводородная.
|

 .
.