Первый металлический водородС водородом, как мы знаем, сегодня связаны, по меньшей мере три надежды: на термоядерную энергию, на передачу энергии почти без потерь (в сверхпроводящих устройствах при температуре жидкого водорода, а не жидкого гелия) и – как на горючее, безвредное для окружающей среды. И все эти надежды связывают прежде всего с металлическим водородом, т.е. таким водородом, который представляет собой твердое тело, обладающее высокой электропроводностью и другими свойствами металла. Компактный металлический водород должен быть наиболее удобным водородом-топливом. Кроме того, есть теоретические предпосылки, согласно которым металлический водород может существовать и при обычной температуре, оставаясь при этом сверхпроводником. Металлический водород пытались (и продолжают пытаться) получить разными способами, подвергая обыкновенный твердый водород статическим или динамическим нагрузкам. Первое сообщение о возможном успехе при решении этой важной и сложной проблемы было опубликовано в феврале 1975 г. группой ученых Института физики высоких давлений АН СССР (во главе с академиком Л.Ф. Верещагиным). Осадив на охлажденные до 4,2°К алмазные наковальни тонкий слой водорода и воздействовав на него очень высоким давлением, наблюдали необычное явление. Электрическое сопротивление водорода уменьшилось в миллионы раз – он перешел в металлическое состояние. Это произошло под статическим давлением порядка 3 млн атм. Когда же давление начали снижать, то уже примерно при троекратном уменьшении давления (1 млн атм.) происходил обратный переход водорода из металлического состояния в обычное, диэлектрическое. Впрочем, этот факт исследователи не воспринимали как фатальную неудачу, означающую невозможность существования металлического водорода при нормальном давлении. Они надеются, что металлический водород как-то удастся «закалить» и со временем сделать доступным для ученых разных специальностей. И для техники, видимо, тоже.
• Гелий • Оглавление |
Водород
[править]
Материал из Википедии — свободной энциклопедии
| ||||
| Внешний вид простого вещества | ||||
 Газ без цвета, запаха и вкуса Газ без цвета, запаха и вкуса
| ||||
| Свойства атома | ||||
| Имя, символ, номер | Водород / Hydrogenium (H), 1 | |||
| Атомная масса (молярная масса) | 1,00794 а. е. м. (г/моль) | |||
| Электронная конфигурация | 1s1 | |||
| Радиус атома | 53 пм | |||
| Химические свойства | ||||
| Ковалентный радиус | 32 пм | |||
| Радиус иона | 54 (−1 e) пм | |||
| Электроотрицательность | 2,20[1] (шкала Полинга) | |||
| Степени окисления | 1,0, −1 | |||
| Энергия ионизации (первый электрон) | 1311,3 (13,595) кДж/моль (эВ) | |||
| Термодинамические свойства простого вещества | ||||
| Плотность (при н. у.) | 0,0000899 (при 273 K (0 °C)) г/см³ | |||
| Температура плавления | 14,01 K | |||
| Температура кипения | 20,28 K | |||
| Теплота плавления | 0,117 кДж/моль | |||
| Теплота испарения | 0,904 кДж/моль | |||
| Молярная теплоёмкость | 14,235[2] Дж/(K·моль) | |||
| Молярный объём | 14,1 см³/моль | |||
| Кристаллическая решётка простого вещества | ||||
| Структура решётки | гексагональная | |||
| Параметры решётки | a=3,780 c=6,167 Å | |||
| Отношение c/a | 1,631 | |||
| Температура Дебая | 110 K | |||
| Прочие характеристики | ||||
| Теплопроводность | (300 K) 0,1815 Вт/(м·К) |
| Водород | |
| H 1,0079 | |
| 1s1 |
Водоро́д — первый элемент периодической системы элементов; обозначается символом H. Название представляет собой кальку с латинского: лат. Hydrogenium (отдр.-греч. ὕδωρ — «вода» и γεννάω — «рождаю») — «порождающий воду». Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H — протон.
Три изотопа водорода имеют собственные названия: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T).
Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен[2]. Растворим в этаноле и рядеметаллов: железе, никеле, палладии, титане, платине.
| Содержание [убрать] · 1 История · 2 Происхождение названия · 3 Распространённость o 3.1 Во Вселенной o 3.2 Земная кора и живые организмы · 4 Получение o 4.1 В промышленности o 4.2 В лаборатории · 5 Физические свойства · 6 Изотопы · 7 Свойства изотопов · 8 Химические свойства o 8.1 Взаимодействие со щелочными и щёлочноземельными металлами o 8.2 Взаимодействие с оксидами металлов (как правило, d-элементов) o 8.3 Гидрирование органических соединений · 9 Геохимия водорода · 10 Меры предосторожности · 11 Экономика · 12 Применение o 12.1 Химическая промышленность o 12.2 Пищевая промышленность o 12.3 Авиационная промышленность o 12.4 Топливо · 13 Интересные факты · 14 См. также · 15 Примечания · 16 Литература · 17 Ссылки |
[править]История
Основная статья: Хронология водородных технологий
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и Михаил Васильевич Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Генри Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
[править]Происхождение названия
Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ — вода и γεννάω — рождаю) — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии с «кислородом» М. В. Ломоносова.
[править]Распространённость
[править] Во Вселенной
Водород — самый распространённый элемент во Вселенной[3]. На его долю приходится около 92 % всех атомов (около 8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
[править] Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
[править]Получение
Основная статья: Производство водорода
См. также: Биотехнологическое получение водорода
[править] В промышленности
· Электролиз водных растворов солей:

· Пропускание паров воды над раскалённым коксом при температуре около 1000 °C:
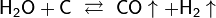
· Конверсия с водяным паром при 1000 °C:

· Каталитическое окисление кислородом:

· Крекинг и риформинг углеводородов в процессе переработки нефти.
· Из природного газа.
[править] В лаборатории
· Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту:

· Взаимодействие кальция с водой:

· Гидролиз гидридов:

· Действие щелочей на цинк или алюминий:


· С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:

[править]Физические свойства


Спектр излучения водорода


Эмиссионный спектр водорода
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н. у.), температура кипения −252,76 °C, удельная теплота сгорания 120,9·106 Дж/кг, малорастворим в воде — 18,8 мл/л.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.


Фазовая диаграмма водорода
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см³) и текучая (вязкость при −253 °C 13,8 сП). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см³ (при −262 °C) — снегоподобная масса, кристаллы гексагональной сингонии, пространственная группаP6/mmc, параметры ячейки a = 0,378 нм и c = 0,6167 нм. При высоком давлении водород переходит в металлическое состояние.
Молекулярный водород существует в двух спиновых формах (модификациях) — в виде орто- и пара водорода. В молекуле ортоводорода o -H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p -H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Равновесная смесь o -H2 и p -H2 при заданной температуре называется равновесный водород e -H2.


Равновесная мольная концентрация пара-водорода
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвёздной среды — с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
[править]Изотопы


Давление пара для различных изотопов водорода
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (T; радиоактивный).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %[4]. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет[4]. Тритий содержится в природе в очень малых количествах.
В литературе[4] также приводятся данные об изотопах водорода с массовыми числами 4—7 и периодами полураспада 10−22—10−23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов[5].
| Температура плавления, K | Температура кипения, K | Тройная точка, K / kPa | Критическая точка, K / kPa | Плотность жидкий / газ, кг/м³ | |
| H2 | 13,96 | 20,39 | 13,96 / 7,3 | 32,98 / 1,31 | 70,811 / 1,316 |
| HD | 16,65 | 22,13 | 16,6 / 12,8 | 35,91 / 1,48 | 114,0 / 1,802 |
| HT | 22,92 | 17,63 / 17,7 | 37,13 / 1,57 | 158,62 / 2,31 | |
| D2 | 18,65 | 23,67 | 18,73 / 17,1 | 38,35 / 1,67 | 162,50 / 2,23 |
| DT | 24.38 | 19,71 / 19,4 | 39,42 / 1,77 | 211,54 / 2,694 | |
| T2 | 20,63 | 25,04 | 20,62 / 21,6 | 40,44 / 1,85 | 260,17 / 3,136 |
Дейтерий и тритий также имеют орто- и парамодификации: p -D2, o -D2, p -T2, o -T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и парамодификаций.
[править]Свойства изотопов
Свойства изотопов водорода представлены в таблице[4][6].
| Изотоп | Z | N | Масса, а. е. м. | Период полураспада | Спин | Содержание в природе, % | Тип и энергия распада | |
| 1H | 1,007 825 032 07(10) | стабилен | 1⁄2+ | 99,9885(70) | ||||
| 2H | 2,014 101 777 8(4) | стабилен | 1+ | 0,0115(70) | ||||
| 3H | 3,016 049 277 7(25) | 12,32(2) года | 1⁄2+ | β− | 18,591(1) кэВ | |||
| 4H | 4,027 81(11) | 1,39(10)·10−22 с | 2− | -n | 23,48(10) МэВ | |||
| 5H | 5,035 31(11) | более 9,1·10−22 с | (1⁄2+) | -nn | 21,51(11) МэВ | |||
| 6H | 6,044 94(28) | 2,90(70)·10−22 с | 2− | −3n | 24,27(26) МэВ | |||
| 7H | 7,052 75(108) | 2,3(6)·10−23 с | 1⁄2+ | -nn | 23,03(101) МэВ |
В круглых скобках приведено среднеквадратическое отклонение значения в единицах последнего разряда соответствующего числа.
Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
[править]Химические свойства


Доля диссоциировавших молекул водорода
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:

Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:

и с единственным неметаллом — фтором, образуя фтороводород:

С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:

Он может «отнимать» кислород от некоторых оксидов, например:

Записанное уравнение отражает восстановительные свойства водорода.

С галогенами образует галогеноводороды:
 , реакция протекает со взрывом в темноте и при любой температуре,
, реакция протекает со взрывом в темноте и при любой температуре,
 , реакция протекает со взрывом, только на свету.
, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:

[править] Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:



Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:

[править] Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
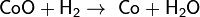
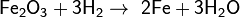

[править] Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.

[править]Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением[7]. Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
[править]Меры предосторожности

Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Считается, что взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % по объему. Такие цифры фигурируют сейчас в большинстве справочников, и ими вполне можно пользоваться для ориентировочных оценок. Однако, следует иметь в виду, что более поздние исследования (примерно конец 80-х) выявили, что водород в больших объёмах может быть взрывоопасен и при меньшей концентрации. Чем больше объём, тем меньшая концентрация водорода опасна.
Источник этой широко растиражированной ошибки в том, что взрывоопасность исследовалась в лабораториях на малых объёмах. Поскольку реакция водорода с кислородом — это цепная химическая реакция, которая проходит по свободнорадикальному механизму, «гибель» свободных радикалов на стенках (или, скажем, поверхности пылинок) критична для продолжения цепочки. В случаях, когда возможно создание «пограничных» концентраций в больших объёмах (помещения, ангары, цеха), следует иметь в виду, что реально взрывоопасная концентрация может отличаться от 4 % как в большую, так и в меньшую стороны.
[править]Экономика
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2-5$ за кг[8]. В небольших количествах перевозится в стальных баллонах зелёного или тёмно-зелёного цвета.
[править]Применение
Атомарный водород используется для атомно-водородной сварки.
[править] Химическая промышленность
· При производстве аммиака, метанола, мыла и пластмасс
[править] Пищевая промышленность
· При производстве маргарина из жидких растительных масел.
· Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ, класс «Прочие»). Входит в список пищевых добавок, допустимых к применению в пищевой промышленности Российской Федерации в качестве вспомогательного средства для производства пищевой продукции.[ источник не указан 725 дней ]
[править] Авиационная промышленность
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
[править] Топливо
Водород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водород в ДВС меньше загрязняет окружающую среду локально (из-за низкого КПД получения водорода и сопряжённых дополнительных расходов на его сжатие, транспортировку, водород как энергоноситель для ДВС совершенно неперспективен), но также как и бензиновые/дизельные аналоги, потребляет и деградирует моторное масло и все остальные неэкологичные материалы, присущие двигателям внутреннего сгорания. В смысле экологии электромобили значительно лучше, перспективен также двигатель Стирлинга.[ источник не указан 60 дней ]
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
[править]Интересные факты
· Хорватское название водорода — Vodik, ввёл в употребление филолог Богослав Шулек.
[править]См. также
· Атом водорода
· Жидкий водород
· Соединения водорода
· Антиводород
· Водородная энергетика
· Молекула водорода
· Молекулярный ион водорода
[править]Примечания
1. ↑; Hydrogen: electronegativities (англ.). Webelements. Проверено 15 июля 2010.
2. ↑ 12 Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1988. — Т. 1. — С. 400—402. — 623 с. — 100 000 экз.
3. ↑; Книга рекордов Гиннесса для химических веществ
4. ↑ 1234 G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
5. ↑; Züttel A.,Borgschulte A.,Schlapbach L. Hydrogen as a Future Energy Carrier.- Wiley-VCH Verlag GmbH & Co. KGaA, 2008. — ISBN 978-3-527-30817-0
6. ↑; G. Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003.
7. ↑; Правилов А. М. Фотопроцессы в молекулярных газах. М.: Энергоатомиздат, 1992.
8. ↑; Аркадий Шварц Снова о водороде Вестник online № 19(356) 15 сентября 2004
[править]Литература
· Начала химии. Современный курс для поступающих в вузы: Учебное пособие для вузов /Н. Е. Кузьменко, В. В. Еремин, В. А. Попков. — М.: Издательство «Экзамен»,2005.
· Учебный справочник школьника. Учебное издание. — М.: Дрофа, 2001.
· Дигонский С. В., Тен В. В. Неизвестный водород. — СПб: Наука, 2006 ISBN 5-02-025114-3
[править]Ссылки

| Портал «Химия» |

| Водород в Викисловаре? |

| Водород на Викискладе? |
П·о·р

 1H
1H





