Пример приготовления растворов с заданной концентрацией.
1. Писаренко Г.С. и другие. Сопротивление материалов. Вища школа. К. 1986. 2. Беляев Н.М. Сопротивление материалов. Наука. М. 1976. 3. Логинов В.Н. Электрические измерения механических величин.- М. Энергия, 1982-103с. 4. Алтурис С., Кобаяси А., Дэппи Д., Райли. и др. Экспериментальная механика.- М: Мир, 1990-615с. Лабораторная работа №М6 КОНДУКТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА КОЛИЧЕСТВАСОДЕРЖАЩИХСЯ В РАСТВОРЕ ВЕЩЕСТВ
Цели работы 1.Получить практические навыки в определении содержания растворимых солей в воде кондуктометрическим методом. 2.Ознакомиться с принципом работы солемера.
Краткие теоретические сведения. Растворы имеют большое значение в жизни и практической деятельности человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т. д.). Производства, в основе которых лежат химические процессы, обычно связаны с использованием растворов. Подробнее в приложении 6. Пример приготовления растворов с заданной концентрацией. Необходимо приготовить 5% раствор NаСl. 1. Рассчитать массу соли, необходимую для приготовления 200 гр раствора указанной массовой доли
2. Рассчитать необходимый объём воды
3. С помощью технологических весов взвесить рассчитанное количество соли 4. Аккуратно перенести навеску соли в мерный стакан. 5. В тот же мерный стакан с солью добавить рассчитанное количество воды. 6. Перемешайте содержимое стакана до полого растворения соли. 7. Требуемый раствор готов. Контроль содержания растворимых солей в воде (пульпе) можно осуществлять на основе зависимости, электропроводности раствора от концентрации находящейся в нем соли (в некоторых случаях щелочи или кислоты). Кристаллические решетки солей построены из ионов. При растворении в воде или другом растворителе с большой диэлектрической проницаемостью вокруг ионов образуются гидратные (сольватные) оболочки, препятствующие их соединению в молекулы. Полученные таким образом растворы электролитов, которые относятся к группе сильных, полностью или почти полностью диссоциированы. В растворах электролитов электрическая энергия перeносится ионами. Способность проводить электричество xapaктеризуется сопротивлением или электропроводностью. Сопротивление проводящей среды (проводника) R, (Ом) пропорционально его длине l (см) и обратно пропорционально поперечному сечению S (см2). Математически эти величины связаны следующим образом:
где r(Ом∙См) - удельное сопротивление, равное сопротивлению проводника при l =1 см и S =1 см2. Величина, обратная сопротивлению, называется электропроводностью и выражается
Удельная электропроводность - величина, обратная удельному сопротивлению и определяется как
Аналитическая зависимость удельной электропроводности от величин, характеризующих состояние однокомпонентного раствора, определяется следующим выражением:
где С - концентрация вещества в растворе; а - коэффициент, характеризующий степень диссоциации раствора; _ f - коэффициент электропроводности, характеризующий силы межионного взаимодействия (обычно f < 1); U+ и U- - подвижности ионов (равны скоростям движения ионов, при напряженности электрического поля 1 В/см). При этом физически удельная электропроводность представляет собой электропроводность I см3 раствора, помещенного между параллельными электродами площадью I см2 при расстоянии между ними 1 см. Электропроводность водных растворов сильных электролитов в основном определяется силами межионного взаимодействия, зависящими от расстояния между ионами и от природы среды. Наличие этих взаимодействии вызывает большее или меньшее взаимное торможение катионов и анионов и, следовательно, понижение их подвижности. Так, удельная электропроводность сильных электролитов зависит от числа ионов в I см3 и их абсолютной скорости, при этом с увеличением концентрации соли число ионов в 1см3 растет, а их абсолютная скорость падает. Взаимодействие этих факторов может привести к неоднозначной зависимости электропроводности от концентрации соли в растворе, что хорошо видно на рис 1.
Pиc.I. Зависимости удельной электропроводности χ от эквивалентной концентрации η водных растворов при температуре 20°С
При автоматическом контроле содержания соли в растворе рабочим участком измерения зависимости χ = f(C) обычно служит начальный участок. Необходимо также отметить, что электропроводность раствора в значительной мере зависит от его температуры. При этом с повышением температуры электропроводность возрастает вследствие увеличения скорости ионов (в силу уменьшения торможения), а также за счет увеличения степени диссоциации. С увеличением температуры водного раствора на 1°С электропроводность увеличивается в среднем на 2-2,5%.
|



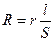 (1)
(1) (Ом-1) (2)
(Ом-1) (2)
 (Ом-1·См-1)
(Ом-1·См-1)




