
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Приклади розв’язання задач
Дата добавления: 2014-11-10; просмотров: 900
|
|
Приклад 1.Визначте максимальну довжину хвилі випромінювання, здатного викликати дисоціацію молекул кисню. Прийняти, що вся енергія фотону витрачається на процес дисоціації, а енергія зв’язку для одного моля кисню, яка дорівнює 498,3 кДж/моль, еквівалентна енергії дисоціації.
Розв’язок:Захоплення фотонного випромінювання може призвести до фотодисоціації молекул кисню:
О2+hυ 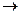 O+O.
O+O.
За умовою задачі енергія дисоціації молекул О2 еквівалентна енергії зв’язків і дорівнює енергії фотону:
Едис= Езв=Еф,
де Езв – енергія зв’язку в одній молекулі кисню.
Езв можна знайти, розділивши значення енергії зв’язків для одного моля на число молекул в одному молі, тобто на число Авогадро:
Езв=498,3/(6,02·1023)=8,28·10-22(кДж/мол.).
Енергія фотону пов’язана з довжиною хвилі випромінювання рівнянням Ейнштейна:
Еф=h∙c/λ,
де h – це постійна Планка; с – швидкість світла в вакуумі; λ – довжина хвилі випромінювання.
Згідно табл. А.1 h=6,626·1034Дж·с; с=2,99·108м/с. Звідси можна визначити максимальну довжину хвилі випромінювання, здатну викликати дисоціацію молекул кисню:
λ= h∙c/Еф= h∙c/Езв;
λ=6,626·1034·2,997·108/(8,28·10-19)=2,40·10-7(м)=240(нм).
Відповідь: максимальна довжина хвилі, що здатна викликати дисоціацію молекули кисню, становить 240нм.
Приклад 2.Оцініть у скільки разів швидкість зв’язування атомарного кисню в реакції синтезу озону вище ніж в реакції його руйнування, коли ці процеси відбуваються при нормальному атмосферному тиску біля поверхні Землі. Концентрація озону в приземному повітрі складає 4·1011 см-3. Константа швидкості реакції утворення озону kутв=6,9·10-34 см6·с-1, якщо трете тіло – молекули кисню. Константа швидкості процесу руйнування озону при взаємодії з атомарним киснем kруйн=8,4·10-15см3·с-1.
Розв’язок: Процеси утворення і руйнування озону в реакції зв’язування атомарного кисню можна представити наступним рівнянням:
О(3Р)+ О2+М 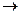 О3+М*
О3+М*
О(3Р)+ О3 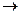 2О2,
2О2,
де O(3P) – атоми кисню в незбудженому стані; М – третє тіло, що приймає участь в реакції утворення озону.
Швидкість процесів утворення і руйнування озону можна виразити рівняннями:
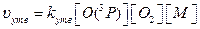
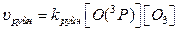
Тоді співвідношення швидкостей реакцій утворення та руйнування озону:
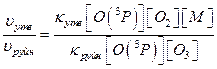
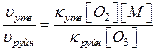
В випадку коли третє тіло в процесі утворення озону – молекули кисню ([O2]=[M]), співвідношення швидкостей реакції складає:
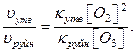
Середнє значення температури повітря приземного шару відповідає середній температурі нижньої межі тропосфери і дорівнює 15ºС.
При нормальному атмосферному тиску концентрація молекул кисню визначається за формулою:
N=NA·T0·α/Vm·103·T
де NA – число Авагадро, мол./моль; T0 і T – температура за нормальних умов і температура в тропосфері, К; α – об’ємна частка кисню в повітрі; Vm – молярний об’єм, моль/л; 103 – коефіцієнт переводу літрів в кубічні сантиметри.
N=6,02·1023·273·0,2095/(22,4·103·288) = 5,34·1018(см-3).
Співвідношення швидкостей реакцій становить:
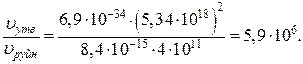
Відповідь:швидкість зв’язування атомарного кисню в реакції утворення озону в 5,9·106 раз більше, ніж в реакції його руйнування.
Приклад 3.Визначте концентрацію атомарного кисню в стані O(3P) на висоті 20км за умови динамічної рівноваги між процесами його утворення (при фотолізі О3 та NO2) і стоку (при утворенні О3). Концентрація озону та діоксиду нітрогену становить: [О3]=1,5·1012см-3, [NO2]=3·104 см-3. Коефіцієнт фотодисоціації озону та діоксиду нітрогену на висоті 20км дорівнює: k1=2,1·10-4 см-1; k2=4,4·10-3 см-1. Константна швидкості реакції утворення озону у випадку, коли третім тілом є молекули азоту, визначається за рівнянням:
κ= 6,2·10-34(Т/300)-2(см6·с-1),
де Т – температура реакції.
Розв’язок:Запишемо процес утворення атомарного кисню у вигляді наступних рівнянь реакцій:
О3+hυ 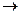 О2+ O(3P)
О2+ O(3P)
NO2+ hυ 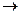 NO+ O(3P)
NO+ O(3P)
Швидкість процесу фотохімічного розкладання озону та діоксиду нітрогену можна виразити рівняннями:
υ1= k1·[O3]
υ2= k2·[NO2].
Швидкість утворення атомарного кисню в O(3P) стані буде дорівнювати сумі швидкостей процесів фотолізу О3 і NO2, оскільки за умовою задачі інші джерела надходження O(3P) не беруться до уваги. В процесі фотохімічного розпаду на кожну молекулу озону та діоксиду нітрогену утворюється один атом кисню. Тому можна записати:
υутв. = υ1+ υ2
Процес стоку атомарного кисню за умовою задачі пов'язаний тільки з утворенням молекул озону:
О2+ O(3P) + М 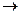 О3+М*.
О3+М*.
Швидкість цієї реакції можна представити наступним рівнянням:
υст=κ[O2]·[O(3P)]·[M],
де κ – константа швидкості реакції утворення озону; [M] – концентрація третього тіла, в даному випадку – концентрація азоту на висоті 20км.
В умовах динамічної рівноваги швидкість процесів утворення та стоку атомарного кисню рівні:
υутв=υст
υ1+υ2=υст
k1·[O3]+k2·[NO2]=κ·[O2]·[O(3P)]·[M]
З отриманого рівняння можна виразити концентрацію атомарного кисню:
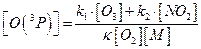
Визначимо температуру на висоті 20км. Її значення необхідно для розрахунку концентрації азоту та константи швидкість реакції утворення озону на вказаній висоті. Ця область знаходиться в стратосфері, і температуру можна визначити за рівнянням:
Тz = 217 + ∆Тсер·(z – 11),
де 217 – температура нижньої границі стратосфери, К; z – висота в стратосфері, для якої визначається температура, км; ∆Тсер – температурний градієнт, в стратосфері, який дорівнює 1,38К/км; 11– середня висота тропосфери, км.
Т20 = 217 + 1,38·(20 – 11)=229 (К).
Для визначення кількості молекул азоту на висоті 20км необхідно спочатку розрахувати кількість молекул повітря на заданій висоті. Вміст молекул повітря в атмосфері спадає зі збільшенням висоти над рівнем моря:
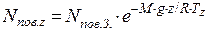
де nпов. z – концентрація молекул в повітрі на висоті z, см-3; nпов. З. – середня концентрація молекул в повітрі на рівні моря (nпов. З.=2,55·1019 см-3); M – середня молярна маса повітря (М=28,95·10-3 кг/моль); g – прискорення сили тяжіння (g=9,8 м/с2); z – висота над рівнем моря, м; R – універсальна газова стала (R=8,31 Дж/(моль·К)); Тz – середня температура повітря на висоті z, К.
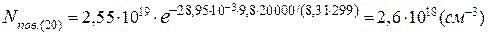
Оскільки в атмосферному повітрі співвідношення основних компонентів до висоти 100км майже не змінюється, концентрація молекул азоту на висоті 20км буде дорівнювати:
[N2]=2,6·1018∙0,7808=2,03·1018(см-3).
Концентрація молекулярного кисню на висоті 20 км становить:
[O2]=2,6·1018·0,2095=5,4·1017(см-3).
Константа швидкості реакції утворення озону на висоті 20км дорівнює:
κ=6,2·10-34 ·(Т/300)-2=6,2·10-34·(229/300)-2=1,07·10-33(см6·с-1).
Концентрація атомарного кисню становить:
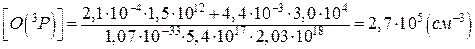
Відповідь:концентрація атомарного кисню становить 2,7·105 см-3
Приклад 4.Який з фреонів – Ф-11 або Ф-152 – представляє найбільшу небезпеку для озонового шару планети?
Розв’язок:У відповідності з системою, розробленою спеціалістами фірми «Дюпон», при класифікації фреонів цифрами позначається різниця між числом, в якому записані підряд цифри, що означають кількість атомів Карбону, Гідрогену та фтору в молекулярній формулі фторхлорвуглеводнів, та деяким «кодовим» числом, яке прийнято рівним 90. Наприклад, Ф-11 буде означати, що в склад сполуки входить 1 атом Карбону, 0 атомів Гідрогену, 1 атом фтору (11+90=101). Оскільки Карбон має валентність 4, в склад молекули фреону Ф-11 повинно входити також 3 атоми Хлору. Тому молекулярна формула фреону Ф-11 відповідає сполуці CFCl3.
В випадку фреону Ф-152 маємо: 152+90=242, тобто в склад фторхлорвуглеводнів входять 2 атоми Карбону, 4 атоми Гідрогену, 2 атоми фтору. Атоми Карбону у фторхлорвуглеводнях зв’язані між собою одинарними зв’язками, тому у фреоні може бути тільки 6 невуглецевих зв’язків. Всі вакантні місця зайняті атомами Гідрогену та Фтору, тому в цьому фреоні не має атомів хлору. Його формула буде такою C2H4F2.
Оскільки фреон Ф-152 не містить хлору він не становить небезпеки озоновому шару. Однак в результаті його трансформації в тропосфері можливе утворення токсичних сполук.
Відповідь: фреон Ф-11, що містить 3 атоми Хлору в кожній молекулі представляє більшу небезпеку для озонового шару, ніж фреон Ф-152, молекули якого не містять Хлору.
Приклад 5.Яка максимальна кількість молекул озону може утворитися в кожному сантиметрі кубічному приземного повітря при повному окисненні метану в присутності оксидів Нітрогену, якщо концентрація метану зменшилась з 20 до 1,6 млн-1. Тиск дорівнює 101,3кПа, температура повітря 288К.
Розв’язок:При повному окисненні метану в присутності оксидів Нітрогену ряд перетворень можна представити наступним сумарним рівнянням реакції:
CH4+8O2+4M 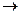 CO2+2H2O+4O3+4M*.
CO2+2H2O+4O3+4M*.
Таким чином, при повному окисненні кожної молекули метану в присутності оксидів Нітрогену може утворитися до 4 молекули озону.
При зменшенні концентрації метану в повітрі з 20 до 1,6млн-1 концентрація озону, що утворився при відсутності його стоку може скласти:
[O3] = 4·(20 – 1,6) = 73,6 (млн-1)
Отже, в 1 см³ повітря може утворитися nO3 молекул озону:
nO3 = NA·α(O3)·Т0/(Vм·103·Тз) (см-3),
де NA – число Авогадро; α(O3) – об’ємна частка озону в повітрі; Vm – молярний об’єм газу за нормальних умов, л; Т0 та Тз – температура повітря за нормальних умов та середня температура біля поверхні Землі (273 та 288 К відповідно).
nO3=6,02·1023·73,6·10-6·273/(22,4·103·288)=1,9·1015 (см-3).
Відповідь: може утворитися до 1,9·1015 молекул О3/см3 повітря.
Приклад 6.Визначте співвідношення швидкостей в процесі газофазного та рідкофазного окиснення SO2 при умові, що загальний вклад в ці процеси вносять такі реакції:
SO2(г)+∙OH(г) 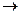 ∙HSO3(г)
∙HSO3(г)
SO2(p-p)+H2O2(p-p) 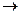 H2SO4(p-p).
H2SO4(p-p).
Константи швидкостей реакції дорівнюють: k1=9·10-13см3·с-1; k2=1·103 л·с-1. Концентрації домішок в газовій фазі складають [∙ОH]=5·106(см-3); [SO2]=1·10-4 % (об.); [H2O2]=1·10-7 % (об.).
Розрахунки провести для атмосферного повітря, що має температуру 25°С та містить: а) 0; б) 0,0001; в) 0,01г вільної води в кожному літрі повітря.
Вважати, що при розчиненні в воді концентрація SO2 в газовій фазі не змінюється. Гази вважати ідеальними та підпорядкованими закону Генрі. Тиск прийняти рівним 1атм.
Розв’язок:Швидкість окиснення SO2 за участю гідроксидного радикалу можна знайти за допомогою рівняння:
υ1= k1[∙ОH]·[SO2],
де k1 – константа швидкості реакції; [∙ОH] та [SO2] – концентрації реагентів в газовій фазі.
Для визначення швидкості реакції переведемо розмірність концентрації SO2 з % (об.) в см-3 і приведемо її до температури 25°С:
[SO2] (см-3)=[SO2] (% об.)·10-2∙NA·Т0/(Vm·103·Т)
[SO2] = 1·10-4 ·10-2 ∙ 6,02·1023 ·273/(22,4·103·298)=2,46·1013(см-3).
Швидкість газофазного окиснення становить:
υ1=9·10-13·5·10-6·2,46·1013= 1,1·108(см-3·с-1).
У випадку знаходження крапельнорідкої води в повітрі окисненню в рідкій фазі сприяє розчинення газів в воді. Концентрацію компонентів в розчині згідно закону Генрі можна визначити за рівнянням:
Сі=КГі·Рі,
де Сі – концентрація і-го компонента в розчині; КГі – значення константи Генрі для і-го компонента; Рі – парціальний тиск і-го компонента в газовій фазі.
Окиснення SO2 в рідкій фазі супроводжується розчинення SO2 та Н2О2 в воді. Константи Генрі для цих газів при 25°С складають (див. табл. А.3):
Кг(SO2)=5,34моль/(л·атм.)
Кг(Н2О2)=1·105моль/(л·атм.).
Парціальний тиск легко знайти якщо відома об’ємна частка відповідного компонента в газовій фазі та загальний тиск повітря:
РSO2=10-4·10-2·1=10-6(атм.)
РН2О2=10-7·10-2·1=10-9(атм.).
Концентрація компонентів в розчині за законом Генрі становить:
[SO2]=5,34·10-6(моль/л)
[Н2О2]=1·105·10-9=1·10-4(моль/л).
Швидкість процесу окиснення SO2 в рідкій фазі можна визначити за рівнянням:
υ2= k2[Н2О2]·[SO2],
υ2=1·103·5,34·10-6·1·10-4=5,34·10-7[моль/(л·с)].
Отримане значення швидкості окиснення SO2 в рідкій фазі показує, що в кожному літрі розчину за секунду буде окиснюватись 5,34·10-7 молів SO2.
Якщо відомий вміст вільної води в повітрі та приймаючи, що густина розчину дорівнює густині води, приведемо значення швидкості окиснення SO2 в рідкій фазі до відповідних одиниць виміру:
υ2[мол/(см3·с)] = υ2[моль/(л·с)]·n·NА/ρ,
де n – вміст крапельно-рідкої води в повітрі, г (води)/см3(повітря); NА – число Авогадро; ρ – густина води, г/л.
Підставивши відповідні значення отримаємо залежність швидкості окиснення від вмісту вологи в повітрі:
υ2=5,34·10-7·n·6,02·1023/1000=3,2·1014·n.
У випадку коли вміст води в повітрі n=0,0001г/л (варіант «б»), співвідношення швидкостей окиснення SO2 в рідкій та газовій фазах складає:
υ1/υ2=1,1·108/(3,2·1014·0,0001·10-3)=3,4.
У випадку n=0,01 г/л (варіант «в»), це співвідношення буде :
υ1/ υ2=1,1·108/(3,25·1014·0,01·10-3)=0,034.
Відповідь: а) при відсутності крапельно-рідкої води в повітрі швидкість окиснення діоксиду сульфуру визначається процесом окиснення в газовій фазі; б) при вмісті вологи в повітрі 0,0001г/л, швидкість окиснення SO2 в газовій фазі буде перевищувати швидкість окиснення в рідкій фазі в 3,4 рази; в) при вмісті вологи в повітрі 0,01г/л, окиснення буде відбуватися з більшою швидкістю в рідкій фазі; в цьому випадку співвідношення швидкостей окиснення SO2 в газовій та рідкій фазах дорівнює 0,034.
Приклад 7.Константа рівноваги реакції утворення монооксиду нітрогену із азоту та кисню при 800К дорівнює 3·10-11. Якого рівноважного значення може досягти концентрація оксиду нітрогену в суміші, якщо вихідна суміш – повітря?
Розв’язок:Процес утворення монооксиду нітрогену записується:
N2+O2 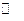 2NO
2NO
Оскільки в процесі утворення монооксиду Нітрогену не відбувається зміни кількості молекул газів в суміші, константу рівноваги Кр при постійному тиску та постійній концентрації можна представити рівнянням:
К=(РNO)2/(PN2·PO2),
де РNO, PN2 та PO2 – парціальний тиск NO, N2 та O2.
Нижче представлені рівноважні значення парціального тиску компонентів суміші в кПа:
| PN2 | PO2 | РNO | |
| На початку процесу | 79,10 | 22,22 | |
| При рівновазі | 79,10-х | 22,22-х | 2х |
Оскільки константа рівноваги процесу утворення монооксиду нітрогену мала, можна припустити, що рівноважне значення парціального тиску NO буде низьким, тому парціальний тиск азоту та кисню майже не змінюється. В зв’язку з цим при розрахунку можна скористатися наближеним рівноважним значення парціальних тисків компонентів суміші:
3·10-11=4х2/(79,10·22,22);
2х = РNO=22,96·10-5(кПа)=0,23(Па).
Відповідь:В повітрі при температурі 800К рівноважний парціальний тиск оксиду Нітрогену становить 0,23 Па.
Приклад 8. Порівняйте швидкості виведення з атмосфери молекул метану при їх взаємодії з гідроксидним радикалом на висотах 5 та 35км. Концентрація метану змінюється від 2 млн-1 на висоті 5км до 0,6млн-1 на висоті 35км. Енергія активації та предекспоненціальний множник константи швидкості реакції взаємодії метану с ОН-радикалом дорівнює 14,1кДж/моль та 2,3см3·с-1 відповідно. Концентрація гідроксидних радикалів відповідає середнім для цих висот значенням: [ OH]5=8,5·105см-3 та [
OH]5=8,5·105см-3 та [ OH]35=3·107см-3.
OH]35=3·107см-3.
Розв’язок: В процесі взаємодії молекул метану з гідроксидним радикалом відбувається утворення води та метильного радикалу:
CH4+ OH
OH 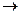
 CH3+ H2O.
CH3+ H2O.
Швидкість реакції описується рівнянням:
υz =kz[CH4]z·[ OH]z,
OH]z,
де υz та kz – швидкість та константа швидкості реакції за умов характерних для атмосферного повітря на висоті z; [CH4]z та [ OH]z – концентрація метану та гідроксидного радикалу на висоті z.
OH]z – концентрація метану та гідроксидного радикалу на висоті z.
У відповідності з рівнянням Арреніуса константа швидкості хімічної реакції залежить від температури:
k = Ae-E/RT,
де k – константа швидкості хімічної реакції; А – предекспоненціальний множник (має розмірність константи реакції); Е – енергія активації реакції, Дж/моль; R – універсальна газова стала, Дж/(моль·К); Т – температура реакції, К.
В даному випадку швидкість хімічної реакції буде визначатися значеннями концентрації реагентів та температурою повітря на заданих висотах.
Температура повітря на висоті 5 і 35км відповідає:
Т5 = 288 + (-6,5·5) = 256 (К),
Т35 =217 + (35 – 11)·1,38 = 250 (К).
Константа швидкості реакції на висоті 5 і 35км складає
k5 = 2,3e-14100/(8,31·256) = 3,04·10-3 (см3·с-1),
k35 =2,3e-14100/(8,31·250) =2,59·10-3 (см3·с-1).
Для розрахунку швидкості хімічної реакції необхідно привести значення концентрації реагентів та констант швидкості до однакових одиниць виміру.
Переведемо дані в задачі значення концентрації метану в см-3:
[CH4]z=Сz(млн.-1)·10-6·Nпов.z(см-3),
де 10-6 – коефіцієнт переводу концентрації, вираженої в млн.-1 в об’ємні частки; Nпов.z – кількість молекул в 1 см3 повітря на заданій висоті.
Кількість молекул в 1см3 повітря на деякій висоті визначаємо за рівнянням:
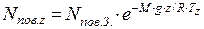
де nпов. z – концентрація молекул в повітрі на висоті z, см-3; nпов. З – середня концентрація молекул в повітрі на рівні моря, см-3; M – середня молярна маса повітря, кг/моль; g – прискорення сили тяжіння, м/с2; z – висота над рівнем моря, м; R – універсальна газова стала, Дж/(моль·К; Тz – середня температура повітря на висоті z, К.
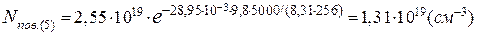
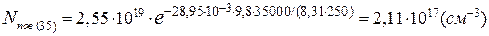
Кількість молекул метану в 1см³ на висоті 5 і 35км становить:
[CH4]5= 2·10-6·1,31·1019=2,62·1013(см-3),
[CH4]35= 0,6·10-6·2,11·1017=1,27·1011(см-3).
Швидкість хімічної реакції на висоті 5 і 35км становить:
υ5 =3,04·10-3·2,62·1013·8,5·105= 6,77·1016(см3·с-1),
υ35 =2,59·10-3·1,27·1011·3·107= 9,87·1015(см3·с-1).
Співвідношення швидкостей хімічних реакцій взаємодії метану з гідроксидним радикалом на різних висотах становить:
υ5/υ35 =6,77·1016/(9,87·1015)= 6,9.
Відповідь: швидкість процесу виводу метану з атмосфери при його взаємодії з гідроксидним радикалом на висоті 5км в 6,9 разів вище ніж на висоті 35км.
Приклад 9.Відомо що монооксид нітрогену може виводитися з атмосфери при взаємодії з молекулами кисню та озону. Розрахуйте час напіввиведення NO з приземного шару атмосферного повітря та визначте, який з цих процесів вносить основний вклад в окиснення NO. Прийняти, що вміст молекул монооксиду нітрогену в повітрі в середньому складає 2·109см-3, а концентрація озону дорівнює 15млрд-1. Константи швидкостей реакцій окиснення монооксиду нітрогену киснем та озоном дорівнюють відповідно: κк=1,93·10-38 см6·мол.-1·с-1 та κо=1,8·10-14см3·мол.-1·с-1. Температура повітря 15ºС, тиск 101,3кПа.
Розв’язок:Визначимо час напіввиведення монооксиду нітрогену з повітря при його взаємодії з молекулярним киснем. Процес окиснення в даному випадку описується наступним рівнянням:
2NO+O2=2NO2.
Швидкість процесу окиснення NO дорівнює:
υNO=kк[O2]·[NO]2,
де υNO – швидкість процесу окиснення NO, см-3·с-1; kк – константа швидкості реакції третього порядку, см6·с-1; [O2] та [NO] – концентрація кисню та монооксиду нітрогену в повітрі, см-3.
Кількість молекул кисню в одному кубічному сантиметрі повітря приземного шару складає:
[O2] =nпов. З·αO2
[O2] = 2,55·1019·0,2095=5,34·1018(см-3).
Так як кількість молекул кисню в повітрі значно перевищує кількість молекул монооксиду нітрогену можна вважати, що концентрація О2 в процесі окиснення NO практично не змінюється. Тому швидкість реакції окиснення монооксиду нітрогену можна представити як швидкість реакції псевдодругого порядку:
υNO=kк' [NO]2,
де kк' – константа швидкості реакції псевдодругого порядку, см3·мол.-1·с-1.
kк'=kк[O2]= 1,93·10-38·5,34·1018=1,031·10-19(см3·с-1).
Для реакції другого порядку час напіввиведення, тобто час за який концентрація вихідних реагентів знижується вдвічі, за умови рівності вихідних концентрації реагентів знаходиться за формулою:
t½=1/(k·С),
де k – константа швидкості реакції другого порядку, см3·с-1; С – концентрація вихідного реагенту, см-3.
В даному випадку для реакції псевдодругого порядку маємо:
t½=1/(kк'·[NO])
t½=1/(1,031·10-19·2·109)= 4,85·109 (с) =150 (років).
Визначимо час напіввиведення монооксиду нітрогену з приземного шару повітря при його взаємодії з озоном.
Реакція окиснення NO озоном має наступний вигляд:
NO+О3 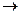 NO2+ O2.
NO2+ O2.
Швидкість реакції можна визначити за рівнянням:
υ'NO= κо [NO]·[O3],
де υ'NO – швидкість процесу окиснення монооксиду нітрогену озоном, см-3·с-1; κо – константа швидкості другого порядку, см3·с-1; [NO] та [O3] – концентрація монооксиду нітрогену та озону в повітрі, см-3.
За умовою задачі, концентрація молекул озону в приземному шарі повітря дорівнює 15 млрд-1 або:
[O3]= 2,55·1019·15·10-9= 3,83·1011(см-3),
де 10-9 – коефіцієнт переводу млрд-1 в об’ємні частки.
Швидкість реакції можна представити як швидкість реакції псевдопершого порядку:
υ'NO= κ'о [NO],
де κ'о – константа швидкості псевдопершого порядку;
κ'о= κо [O3]= 1,8·10-14 ·3,83·1011=6,89·10-3(с-1).
Для реакцій першого порядку час напіввиведення реагенту визначається за формулою:
t½=0,693/k,
де k – константа швидкості реакції першого порядку.
В даному випадку для реакції псевдопершого порядку маємо:
t½=0,69/(6,89·10-3)=100(с.)=1,7(хв.).
Час напіввиведення монооксиду нітрогену в процесі його взаємодії з киснем повітря значно більше, ніж при взаємодії NO з озоном, та не відповідає реальності, що спостерігається в приземному шарі повітря. В атмосферному повітрі час напіввиведення монооксиду нітрогену зазвичай складає кілька хвилин. Тому можна стверджувати, що в приземному шарі повітря процес окиснення монооксиду нітрогену зв’язаний в основному з його взаємодією з озоном.
Відповідь: Час напіввиведення монооксиду нітрогену в процесі його взаємодії з киснем та озоном становить 150 років та 1,7 хвилин відповідно. В приземному шарі повітря процес окиснення NO в основному відбувається за участю озону.
| <== предыдущая лекция | | | следующая лекция ==> |
| Хмарного шару | | | Задачі для самостійного розв’язання |