
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Теоретичні відомості
Дата добавления: 2015-09-19; просмотров: 497
|
|
ВАРИАНТЫ КОНТРОЛЬНОЙ РАБОТЫ ПО ТЕМЕ: «АМИНОКИСЛОТЫ: КЛАССИФИКАЦИЯ, СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ РОЛЬ»
Вариант 1
1. Приведите примеры гетероциклических аминокислот, производных пропионовой кислоты. Напишите их формулу, укажите название, биологическую роль.
2. Какие из перечисленных аминокислот относятся к полярным незаряженным: лейцин, глутамин, фенилаланин, треонин, валин? Напишите их формулы.
Вариант 2
1. Пролин и гидроксипролин (классификация, структура, биологическая роль).
2. Напишите формулы серосодержащих аминокислот, укажите их биологическую роль.
Вариант 3
1. Напишите формулу аминокислоты, не имеющей стереоизомеров. К какому классу по классификации Ленинджера она относится? Укажите ее биологическую роль.
2. Пирролидин-α-карбоновая кислота. Напишите ее формулу, укажите тривиальное название, классификацию и биологическую роль.
Вариант 4
1. Напишите формулу гомоциклических аминокислот. К каким классам по классификации Ленинджера они относятся? Укажите их биологическую роль.
2. Лизин (структура, классификация, номенклатура и биологическая роль).
Вариант 5
1. Напишите формулу незаменимых аминокислот с разветвленной углеродной цепочкой. К какому классу по классификации Ленинджера они относятся? Укажите их биологическую роль.
2. Напишите формулу аминоуксусной кислоты и α-амино-β-фенилпропионовой кислоты. Укажите их тривиальное название, классификацию и биологическую роль.
Вариант 6
1. Напишите формулу триптофана и серина. Укажите химическое название, классификацию и биологическую роль.
2. Напишите формулу α-амино-γ-метилтиомасляной кислоты и α-амино-изовалерьяновой кислоты. Укажите тривиальное название, биологическую роль, классификацию.
Вариант 7
1. Какие из перечисленных аминокислот (лизин, валин, глутами-новая кислота, треонин) являются гидрофобными неполярными? Напишите их формулы, укажите биологическую роль.
2. Аргинин (структура, классификация, биологическая роль).
Вариант 8
1. Из перечисленных ниже аминокислот укажите гидроксилсодержащие аминокислоты: валин, тирозин, аргинин, серин, аспарагин. Напишите, к какому классу (по всем трем классификациям) они относятся, укажите их биологическую роль.
2. α-амино-β-индолил-пропионовая кислота. Напишите ее формулу, тривиальное название, укажите биологическую роль.
Вариант 9
1. Напишите формулу аминокислоты, способной образовывать дисульфидные мостики в структуре белков. Укажите ее название, классификацию, биологическую роль.
2. Моноаминодикарбоновые кислоты и их амиды. Структура, класси-фикация и биологическая роль.
Вариант 10
1. Напишите формулу аминокислоты, не имеющей стереоизомеров. Укажите ее название, классификацию и биологическую роль.
2. Перечислите аминокислоты, которые относятся к классу неполярных, гидрофобных. Напишите формулы циклических, укажите их биологическую роль.
Вариант 11
1. Какие аминокислоты участвуют в образовании глутатиона? Напишите его формулу и формулы этих аминокислот, укажите их биологическую роль, классификацию.
2. Гистидин (структура, биологическая роль и классификация).
Вариант 12
1. Положительно заряженные аминокислоты, структура, классификация и биологическая роль.
2. Аминокислота – донор метильной группы. Напишите ее формулу, укажите название и классификацию.
Вариант 13
1. Отрицательно заряженные аминокислоты, структура, классификация и биологическая роль.
2. Из чего образуются в организме гистамин, триптамин и серото-нин? Напишите формулы этих аминокислот и биогенных аминов.
Вариант 14
1. Приведите примеры гетероциклических аминокислот, производ-ных пропионовой кислоты. Напишите их формулу, укажите тривиальное название, классификацию и биологическую роль.
2. Из каких аминокислот могут образовываться в организме трупные яды? Напишите формулы этих аминокислот и продуктов их декарбоксилирования.
Вариант 15
1. Пролин и гидроксипролин, структура, классификация и биоло-гическая роль.
2. Напишите формулы аминокислот, участвующих в процессах обезвреживания аммиака в организме человека и животных, укажите, к какому классу по классификации Ленинджера они относятся, их биологическая роль.
Вариант 16
1. Напишите формулу глутаминовой кислоты, валина и гистидина. К каким классам по классификации Ленинджера они относятся? Укажите их биологическую роль.
2. Какая аминокислота применяется в медицинской практике для подавления возбуждения ЦНС? Почему? Напишите формулы ее и биогенного амина, образующегося в организме из этой аминокислоты.
Вариант 17
1. Напишите формулы аминокислот, являющихся производными пропионовой кислоты и относящихся к классу полярных незаряженных. Укажите их название, биологическую роль.
2. Триптофан, структура, классификация и биологическая роль.
Вариант 18
1. Какие из перечисленных аминокислот относятся к классу положительно заряженных: лейцин, аргинин, глицин, лизин, фенилаланин? Напишите их формулу и укажите биологическую роль.
2. Тирозин, структура, классификация и биологическая роль.
Вариант 19
- Перечислите незаменимые для человека аминокислоты. Напишите формулы циклических аминокислот из них, укажите их название, классификацию и биологическую роль.
- Цистеин, структура, классификация и биологическая роль.
Вариант 20
1. Серосодержащая незаменимая аминокислота. Структура, классификация и биологическая роль.
2. Гомоциклические аминокислоты, структура, классификация и биологическая роль.
ВАРИАНТЫ КОНТРОЛЬНОЙ РАБОТЫ ПО ТЕМЕ «НОМЕНКЛАТУРА ОТДЕЛЬНЫХ ФЕРМЕНТОВ»
Вариант 1
1. Напишите название ферментов, катализирующих следующие реакции:
а)
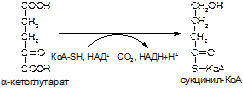
б)
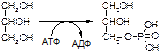
в)
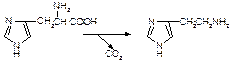
2. Напишите формулу продукта реакции:
а)
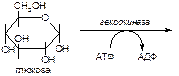
б)
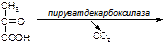
Вариант 2
1. Напишите название ферментов, катализирующих следующие реакции:
а)
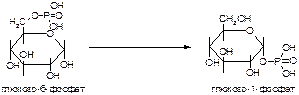
б)
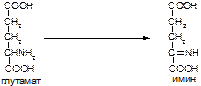
в)
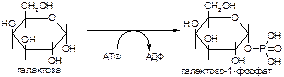
2. Напишите формулу продукта реакции:
а)

б)
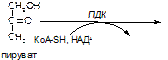
Вариант 3
1. Напишите название ферментов, катализирующих следующие реакции:
а)
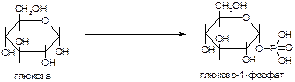
б)

в)
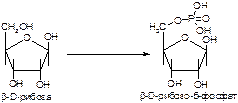
2. Напишите формулу продукта реакции:
а)
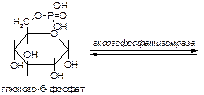
б)
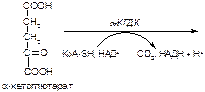
Вариант 4
1. Напишите название ферментов, катализирующих следующие реакции:
а)
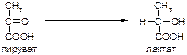
б)

в)
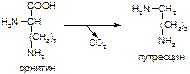
2. Напишите формулу продукта реакции:
а)
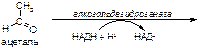
б)
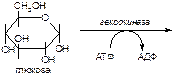
Вариант 5
1. Напишите название ферментов, катализирующих следующие реакции:
а)
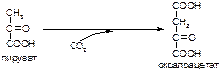
б)

в)
2. Напишите формулу продукта реакции:
а)
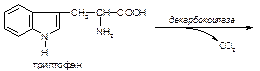
б)
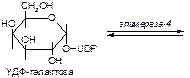
Вариант 6
1. Напишите название ферментов, катализирующих следующие реакции:
а)

б)

в)

2. Напишите формулу продукта реакции:
а)
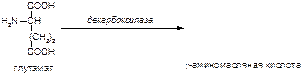
б)
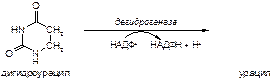
Вариант 7
1. Напишите название ферментов, катализирующих следующие реакции:
а)
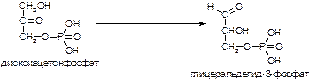
б)

в)
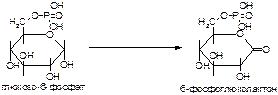
2. Напишите формулу продукта реакции:
а)
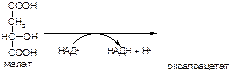
б)
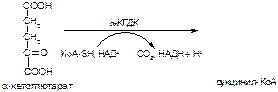
Вариант 8
1. Напишите название ферментов, катализирующих следующие реакции:
а)
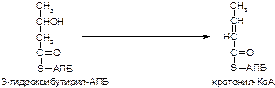
б)
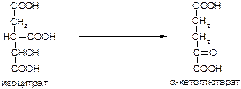
в)
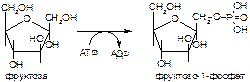
2. Напишите формулу продукта реакции:
а)
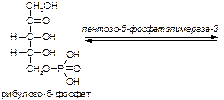
б)
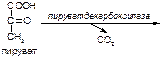
Вариант 9
1. Напишите название ферментов, катализирующих следующие реакции:
а)
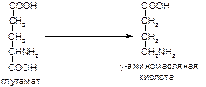
б)
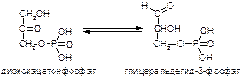
в)
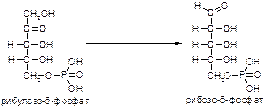
2. Напишите формулу продукта реакции:
а)
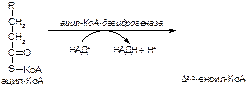
б)
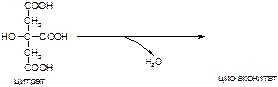
Вариант 10
1. Напишите название ферментов, катализирующих следующие реакции:
а)

б)

в)
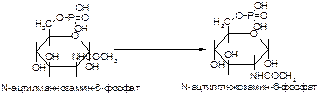
2. Напишите формулу продукта реакции:
а)
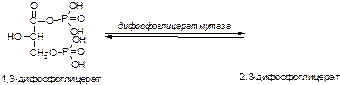
б)
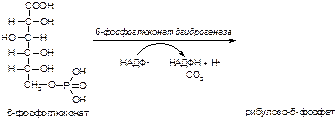
Вариант 11
1. Напишите название ферментов, катализирующих следующие реакции:
а)
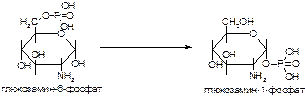
б)
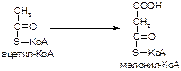
в)

2. Напишите формулу продукта реакции:
а)
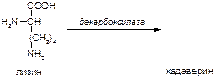
б)
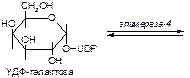
Вариант 12
1. Напишите название ферментов, катализирующих следующие реакции:
а)

б)

в)

2. Напишите формулу продукта реакции:
а)
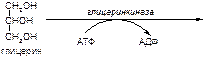
б)
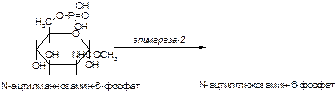
Вариант 13
1. Напишите название ферментов, катализирующих следующие реакции:
а)
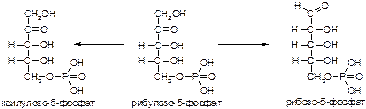
б)
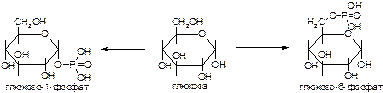
в)
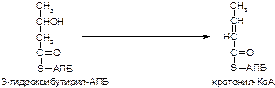
2. Напишите формулу продукта реакции:
а)
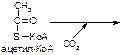
б)
Вариант 14
1. Напишите название ферментов, катализирующих следующие реакции:
а)

б)
в)

2. Напишите формулу продукта реакции:
а)
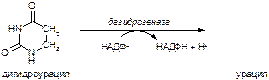
б)
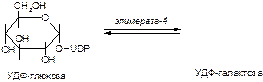
Вариант 15
1. Напишите название ферментов, катализирующих следующие реакции:
а)
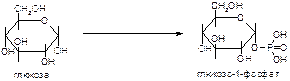
б)
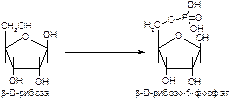
в)
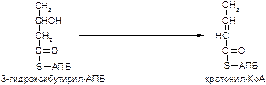
2. Напишите формулу продукта реакции:
а)
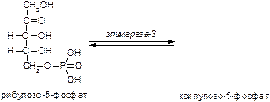
б)
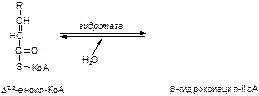
Вариант 16
1. Напишите название ферментов, катализирующих следующие реакции:
а)

б)

в)
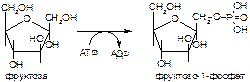
2. Напишите формулу продукта реакции:
а)
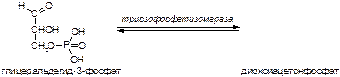
б)
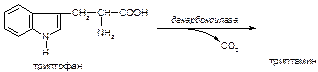
Вариант 17
1. Напишите название ферментов, катализирующих следующие реакции:
а)
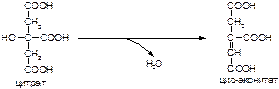
б)
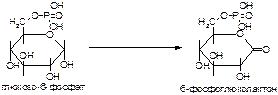
в)
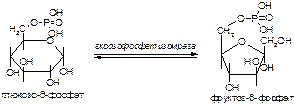
2. Напишите формулу продукта реакции:
а)

б)
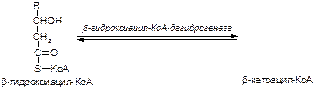
Вариант 18
1. Напишите название ферментов, катализирующих следующие реакции:
а)
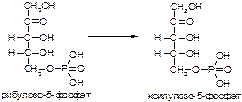
б)
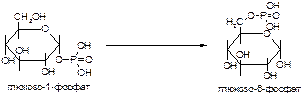
в)
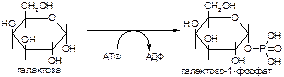
2. Напишите формулу продукта реакции:
а)
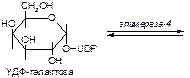
б)
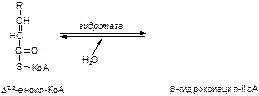
Вариант 19
1. Напишите название ферментов, катализирующих следующие реакции:
а)

б)

в)

2. Напишите формулу продукта реакции:
а)
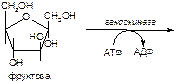
б)
ВАРИАНТЫ КОНТРОЛЬНОЙ РАБОТЫ ПО ТЕМЕ
«СТРОЕНИЕ И БИОЛОГИЧЕСКАЯ РОЛЬ НУКЛЕОТИДОВ И НУКЛЕИНОВЫХ КИСЛОТ
Вариант 1
1. Напишите формулу мажорного пиримидинового основания, которое входит в состав ДНК и не входит в РНК.
2. Напишите формулу гуанозина.
3. Напишите формулу цАМФ, участвующей в активировании ферментов и проведении гормонального сигнала.
4. Свойства генетического кода.
5. Аминокислота изолейцин кодируется кодоном ЦУА. Напишите последовательность нуклеотидов в антикодоновой петле её тРНК.
Вариант 2
1. Напишите формулу мажорного пиримидинового основания, которое входит в состав РНК и не входит в ДНК.
2. Напишите формулу тимидина.
3. Напишите формулу нуклеотида, используемого в клетке для активирования аминокислот.
4. Правила Чаргафа.
5. Аминокислота изолейцин кодируется кодоном АУЦ. Напишите последовательность нуклеотидов в антикодоновой петле её тРНК.
Вариант 3
1. Напишите формулу минорного пиримидинового азотистого основа-ния, которое входит в состав псевдоуридиловой петли тРНК.
2. Напишите формулу аденозина.
3. Напишите формулу нуклеотида, используемого в клетке для активирования глюкозы и других углеводов.
4. Биологическая роль нуклеотидов.
5. Аминокислота метионин кодируется кодоном АУГ. Напишите последовательность нуклеотидов в антикодоновой петле её тРНК.
Вариант 4
1. Напишите формулу минорного пуринового основания, которое входит в состав КЭП-участка мРНК.
2. Напишите формулу уридина.
3. Напишите формулу нуклеотида, используемого в клетке для активирования глицеролсодержащих соединений и других липидов.
4. Строение и биологическая роль ДНК.
5. Аминокислота валин кодируется кодоном ГУЦ. Напишите последовательность нуклеотидов в антикодоновой петле её тРНК.
Вариант 5
1. Какое пиримидиновое азотистое основание входит в состав любой нуклеиновой кислоты (ДНК и РНК)?
2. Напишите формулу дезоксирибозилтимидина.
3. Напишите формулу нуклеотида, используемого в клетке для активирования холина и других азотсодержащих соединений.
4. Строение и биологическая роль мРНК.
5. Аминокислота аланин кодируется кодоном ГЦА. Напишите после-довательность нуклеотидов в антикодоновой петле её тРНК.
Вариант 6
1. Приведите примеры мажорных пуриновых оснований. Напишите их формулы.
2. Напишите формулу цитидина.
3. Напишите формулу нуклеотида, являющегося самой распростра-нённой формой запасания энергии в клетке.
4. Строение и биологическая роль рРНК и рибосом.
5. Аминокислота аспартат кодируется кодоном ГАУ. Напишите последовательность нуклеотидов в антикодоновой петле её тРНК.
Вариант 7
1. Приведите примеры мажорных пиримидиновых оснований. Напи-шите их формулы.
2. Напишите формулу дезоксирибозиладенозина.
3. Напишите формулу нуклеотида, участвующего в гормональной регуляции транспорта ионов через мембрану (цГМФ).
4. Строение и биологическая роль тРНК.
5. Аминокислота серин кодируется кодоном АГЦ. Напишите после-довательность нуклеотидов в антикодоновой петле её тРНК.
ОСНОВНЫЕ ВОПРОСЫ К ЭКЗАМЕНАЦИОННЫМ БИЛЕТАМ
ПО БИОЛОГИЧЕСКОЙ ХИМИИ
I. Белки. Аминокислоты
1. Биологическая роль и классификация белков.
2. Аминокислоты, входящие в состав белков. Их строение и классификация.
3. Заменимые и незаменимые аминокислоты. Биологическая ценность белков.
4. Методы изучения структуры белков.
5. Современные представления о структуре белков. Типы связей в молекуле белка.
6. Первичная структура белков и методы ее изучения. Наследственные изменения первичной структуры белков. Видовая специфичность первичной структуры белков.
7. Вторичная структура белков. Особенность электронного строения пептидной связи как определяющий фактор в формировании конформаций вторичной структуры белков. Методы исследования вторичной структуры белков.
8. Третичная структура белков. Шапероны: классификация и роль в формировании третичной структуры. Методы исследования третичной структуры белков.
9. Домены, их роль в функционировании белков.
10. Четвертичная структура белков. Примеры строения олигомерных белков. Понятие субъединицы. Методы исследования четвертичной структуры белков.
11. Полиморфизм белков.
12. Иммуноглобулины: классификация, особенность строения и функционирования. Причины происхождения разнообразия антител.
13. Физико-химические свойства белков и методы их выделения.
14. Белки плазмы крови.
15. Белки системы свертывания крови.
16. Гемоглобин: структура, функция, молекулярная гетерогенность.
17. Метаболизм гемоглобина и его нарушения.
18. Применение белков и аминокислот в медицинской практике.
II. Ферменты
19. Многообразие, классификация и номенклатура ферментов.
20. Химическая природа ферментов. Мультиэнзимные комплексы. Изоферменты.
21. Кофакторы и коферменты, их роль в катализе.
22. Активный центр ферментов. Общее представление о механизме действия ферментов.
23. Свойства ферментов.
24. Основы кинетики ферментативных реакций.
25. Специфичность действия ферментов.
26. Влияние ингибиторов и активаторов на активность ферментов. Типы ингибирования.
27. Регуляция действия ферментов.
28. Изменение активности ферментов при болезнях (наследственные энзимопатии).
29. Применение ферментов в медицине.
III. Нуклеиновые кислоты
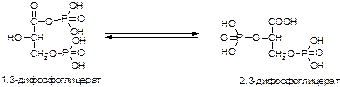
30. Состав, строение и биологическая роль нуклеозидмоно-, ди- и трифосфатов.
31. Конформации нуклеотидов и углеводных компонентов.
32. Структура и биологическая роль циклических мононуклеотидов.
33. Биологическая роль и пути биосинтеза АТФ.
34. Структурная организация нуклеиновых кислот.
35. Рибосомные РНК, рибосомы.
36. Транспортные РНК.
37. Матричные РНК.
38. Биологический код и его свойства.
39. Состав, строение и биологическая роль ДНК.
40. Правила Чаргафа. Укладка ДНК в хроматине и хромосомах.
IV. Биомембраны
41. Основные мембраны клетки и их функции. Свойства мембран.
42. Липидный состав мембран. Роль липидов в формировании липидного бислоя. Влияние холестерина на возможность латеральной диффузии липидов и белков. Участие фосфолипаз в обмене фосфолипидов.
43. Белки мембран – интегральные, поверхностные, «заякоренные». Значение посттрансляционных модификаций в образовании функционально активных мембранных белков.
44. Механизмы переноса веществ через мембраны: простая диффузия, первично активный транспорт, пассивный симпорт и антипорт, вторично активный транспорт, регулируемые каналы.
45. Трансмембранная передача сигнала. Участие мембран в активации внутриклеточных регуляторных систем – аденилатциклазной и инозитолфосфатной и передаче сигнала липидорастворимых стероидных гормонов, тироксина. Каталитические мембранные рецепторы (на примере инсулина).
V. Углеводы. Липиды
46. Структура и биологическая роль важнейших для организма человека ди- и гомополисахаридов.
47. Строение и функции углеводных компонентов гликопротеинов (протеогликанов) и гликолипидов.
48. Пищевые жиры: структура, биологическая роль.
49. Биологическая роль и структура глицерофосфолипидов.
50. Биологическая роль и структура сфинголипидов. Сфинголипидозы.
51. Биологическая роль и структура стероидов.
52. Липопротеины плазмы крови. Липопротеинемии.
53. Структура и функции биомембран.
VI. Витамины
54. Классификация и номенклатура витаминов.
55. Особенности метаболизма водо- и жирорастворимых витаминов. Виды и причины нарушений обмена.
56. Коферментная функция витаминов.
57. Витамины группы А.
58. Витамины группы D.
59. Витамины группы Е.
60. Витамины группы К.
61. Витамин F.
62. Витамин В1.
63. Витамин В2.
64. Пантотеновая кислота.
65. Витамин РР.
66. Витамин В6.
67. Биотин.
68. Аскорбиновая кислота.
69. Фолиевая кислота: структура, биологическая роль.
70. Антианемические витамины.
71. Антигеморрагические витамины.
72. Витамины – регуляторы зрения.
73. Незаменимые пищевые факторы.
VII. Энергетический обмен.
Митохондриальная цепь переноса электронов
74. Макроэргические соединения. Пути биосинтеза АТФ.
75. Биологическое окисление.
76. Принципы, схема и структурная организация дыхательной цепи.
77. Ферменты дыхательной цепи. Химическое строение их простетических групп.
78. Пиридинзависимые дегидрогеназы.
79. Флавинзависимые дегидрогеназы.
80. Ферменты цитохромной системы.
81. Компоненты дыхательной цепи неферментной природы.
82. Окислительное фосфорилирование АДФ. Механизмы сопряжения и фосфорилирования в дыхательной цепи.
83. Нарушение энергетического обмена. Гипоэнергетические состояния.
84. Регуляция биологического окисления и окислительного фосфорилирования.
85. Сравнительная характеристика окисления на сопрягающих и несопрягающих биомембранах.
86. Образование токсических форм кислорода, механизм их повреждающего действия на клетки.
87. Понятие о системе антиоксидантной защиты клетки.
VIII. Обмен и функции углеводов
88. Переваривание и всасывание углеводов в пищеварительном тракте. Нарушения этих процессов, причины.
89. Глюкоза как важнейший энергетический субстрат и метаболит углеводного обмена: общая схема источников и путей расходования глюкозы в организме.
90. Катаболизм глюкозы. Сравнительная характеристика основных путей распада глюкозы.
91. Гликолиз и его биологическая роль.
92. Спиртовое и молочно-кислое брожение.
93. Гликогенолиз.
94. Челночные механизмы транспорта электронов и протонов из цитозоля в митохондрии.
95. Первый этап аэробного окисления глюкозы.
96. Окислительное декарбоксилирование пировиноградной кислоты.
97. Цикл трикарбоновых кислот.
98. Баланс энергии распада глюкозы в аэробных процессах.
99. Пентозофосфатный путь превращения глюкозы.
100. Окислительный и неокислительный пути образования пентоз.
101. Глюконеогенез. Регуляция этого процесса в абсортивный и постабсортивный период.
102. Обмен фруктозы в организме человека.
103. Включение в общие метаболические процессы экзогенной галактозы.
104. Метаболизм гликогена. Гликогенозы и агликогенозы.
105. Роль УДФ-глюкозы в обмене углеводов.
106. Роль печени в обмене углеводов.
107. Изменения обмена углеводов в абсортивный, постабсортивный периоды и в период голодания.
108. Особенности обмена углеводов в эритроцитах.
109. Нарушения обмена углеводов.
IX. Обмен и функции липидов
110. Важнейшие липиды тканей человека. Классификация и биологическая роль.
111. Переваривание и всасывание пищевых липидов в ЖКТ. Нарушение этих процессов.
112. Структура и роль желчных кислот.
113. Незаменимые факторы питания липидной природы.
114. Ресинтез жиров в кишечнике. Роль хиломикронов в обмене жиров.
115. Окисление жирных кислот. Баланс энергии окисления.
116. Биосинтез жирных кислот.
117. Обмен триацилглицеролов в тканях.
118. Депонирование и мобилизация жиров в жировой ткани, регуляция синтеза и распада жиров.
119. Биосинтез фосфатидной кислоты и ее роль в метаболизме глицеролсодержащих липидов.
120. Понятие о биосинтезе сфинголипидов. Сфинголипидозы.
121. Холестерол: функции, обмен.
122. Биохимические основы развития атеросклероза.
123. Биосинтез и использование кетоновых тел.
124. Перекисное окисление липидов. Роль в патогенезе повреждений клетки.
125. Роль печени в обмене липидов.
126. Нарушения обмена липидов.
XIII. Обмен простых белков
127. Ферментативный гидролиз белков в пищеварительном тракте.
128. Частичный и полный внутриклеточный протеолиз белков, его роль.
129. Источники и основные пути использования аминокислот в клетках. Понятие о глюкогенных и кетогенных аминокислотах.
130. Биологическая ценность белков. Азотистый баланс.
131. Дезаминирование аминокислот.
132. Трансаминирование аминокислот.
133. Декарбоксилирование аминокислот. Биогенные амины (гистамин, серотонин, триптамин, γ-аминомасляная кислота, катехоламины): образование, биологическая роль и инактивация.
134. Основные пути биосинтеза заменимых аминокислот (на примере аланина и аспартата).
135. Основные источники аммиака в организме. Механизм его токсического действия.
136. Пути использования и обезвреживания аммиака в организме.
137. Современные представления о биосинтезе мочевины.
138. Гипераммониемия. Причины возникновения.
139. Реакции трансметилирования. Роль глицина, серина и метионина в образовании одноуглеродных групп в реакциях трансметилирования.
140. Глюкогенные аминокислоты. Начальные этапы превращения серина, цистеина и треонина в глюкозу.
141. Роль глутаминовой и аспарагиновой кислот в обмене веществ.
142. Обмен фенилаланина и тирозина в разных тканях. Наследственные нарушения обмена фенилаланина и тирозина.
143. Биологическая роль гистидина. Экстрактивные вещества мышц.
144. Нарушения обмена простых белков и аминокислот.
145. Важнейшие механизмы обезвреживания веществ в печени.
146. Общая характеристика матричных синтезов.
147. Подготовительная стадия биосинтеза белка.
148. Основные этапы трансляции.
149. Стадия инициации в биосинтезе белка.
150. Этапы элонгации в биосинтезе белка.
151. Стадия терминации в трансляции. Посттрансляционные изменения в молекуле белка.
152. Регуляция биосинтеза белка.
153. Роль печени в обмене белков.
XIII. Обмен нуклеиновых кислот
154. Распад нуклеиновых кислот в пищеварительном тракте и тканях.
155. Основные и запасные пути распада пуриновых нуклеотидов.
156. Катаболизм пиримидиновых нуклеотидов.
157. Биосинтез пиримидиновых нуклеотидов. Наследственная оротацидурия.
158. Основные и «запасные» пути биосинтеза пуриновых нуклеотидов.
159. Биосинтез нуклеотидов, необходимых для синтеза ДНК.
160. Нарушения обмена нуклеотидов и нуклеозидов.
161. Репликация.
162. Транскрипция. Обратная транскрипция.
163. Причины и виды повреждений ДНК.
164. Механизмы генетической изменчивости. Полиморфизм белков. Наследственные болезни.
165. Виды и принципы работы системы репарации. Нарушения системы репарации.
166. Особенности метаболизма опухолевых клеток.
167. Молекулярные аспекты неопластической трансформации клетки.
XIII. Гормоны
168. Основные системы регуляции метаболизма и межклеточной коммуникации.
169. Классификация гормонов. Общая характеристика метаболизма гидрофильных и липофильных гормонов.
170. Сравнительная характеристика механизма действия интра- и экстраклеточных гормонов.
171. Тиреоидные гормоны: структура, биосинтез, влияние на обмен веществ. Изменение метаболизма при гипо- и гипертиреозе.
172. Регуляция обмена кальция и фосфора в организме человека.
173. Гормоны мозгового вещества надпочечников: структура, биосинтез, биологическая роль.
174. Регуляция обмена основных энергоносителей.
175. Кортикостероиды: структура, биологическая роль.
176. Гормоны поджелудочной железы (структура, синтез, биологическая роль).
177. Изменение гормонального статуса и метаболизма при сахарном диабете.
178. Метаболизм, механизм действия и биологическая роль адреналина.
179. Механизм действия контринсулярных гормонов на липидный обмен.
180. Механизм действия контринсулярных гормонов на углеводный обмен.
181. Роль гормонов в регуляции репродуктивной функции организма.
182. Роль инсулина в обеспечении гомеостаза.
XIII. Механизмы обезвреживания токсических веществ
183. Основные механизмы обезвреживания токсических веществ.
184. Биотрансформация лекарственных веществ.
ТИПОВЫЕ ЗАДАЧИ К ЭКЗАМЕНАЦИОННЫМ БИЛЕТАМ
I. Белки
1. Что называется коэффициентом изнашивания и физиологическим минимумом белка?
2. В лаборатории СЭС при анализе белка на его пищевую ценность оказалась положительной ксантопротеиновая проба. Является ли данный белок полноценным? Наличие каких аминокислот в белке подтверждает эта проба?
3. В биохимической лаборатории установлено, что при полном гидролизе трипептида образуются треонин, лизин и метионин. С помощью реакции Сенгера получено динитробензольное произ-водное метионина, а после действия карбоксипептидазы выделили лизин. Отразите первичную структуру этого пептида и назовите его.
4. В результате полного кислотного гидролиза тетрапептида была получена смесь из следующих аминокислот – мет, ала, тре и фен. При обработке пептида реактивом Эдмана поэтапно были выделены гидантоин метионина и затем гидантоин аланина. При взаимодействии пептида с гидразином и дальнейшем осаждении бензальдегидом гидразидов, образовавшихся в этой реакции, в растворе остался фенилаланин. Напишите первичную структуру пептида и его название.
5. В результате полного кислотного гидролиза пептида была получена смесь из 4 аминокислот (сер, фен, лиз и ала). При обработке пептида реактивом Эдмана поэтапно были выделены гидантоины серина и затем – аланина. После взаимодействия пептида с гидразином и последующим осаждением гидразидов оставшаяся в растворе аминокислота дала желтое окрашивание с концентрированной азотной кислотой (ксантопротеиновая проба). Напишите первичную структуру пептида и его название.
6. В результате изучения первичной структуры пентапептида сначала был выделен гидантоин метионина, гидантоин аланина и треонина. При обработке пептида гидразином и дальнейшем осаждении бензальдегидом в растворе оказался фенилаланин. Кроме того, положительной оказалась и реакция Фоля. Напишите первичную структуру пептида и его название.
7. В результате полного кислотного гидролиза было установлено, что пептид состоит из 3 аминокислот: вал, гли и глу. При проведении реакции Сенджера с раствором пептида было получено динитро-бензольное производное глицина, а при действии карбоксипепти-дазы был выделен валин. Напишите последовательность располо-жения аминокислотных остатков в пептиде. Укажите химическое название пептида.
8. Методами кислотного гидролиза и распределительной хроматогра-фии было установлено, что в состав пептида входит 4 аминокислоты: гли, сер, фен, ала. При последовательной обработке пептида реактивом Эдмана были получены гидантоины аланина и затем серина. В результате действия карбоксипеп-тидазы был идентифицирован глицин. Напишите первичную структуру данного пептида и укажите его название.
9. К коротким пептидам, играющим очень важную роль в организме человека, относится трипептид глутатион. Он необходим для действия ряда ферментов, обладает антиоксидантным свойством, защищает мембраны эритроцитов от токсического действия различных веществ. В результате биохимического анализа было доказано, что N-концевой аминокислотой в этом пептиде является глу, а с помощью карбоксипептидазы был идентифицирован гли. Но своими уникальными свойствами пептид обладает благодаря наличию в структуре тиогруппы. Напишите первичную структуру пептида, укажите его химическое и тривиальное название.
10. Энкефалины – пентапептиды, в организме человека образуются в результате частичного протеолиза β-липотропина. Опиоидное действие энкефалинов и эндорфинов обусловлено строго определённой последовательностью 4 аминокислот с N-конца: тир-гли-гли-фен-. Метионин- и лейцин-энкефалины отличаются лишь С-концевой аминокислотой. Напишите первичную структуру этих энкефалинов, укажите название пептида.
11. Энкефалины – пентапептиды, обладают мощным обезболивающим действием, превосходящим анальгезирующий эффект морфина в сотни и тысячи раз. Опиоидное действие энкефалинов обусловле-но строго определенной последовательностью 4 аминокислот с N-конца: тир-гли-гли-фен-. С-концевой аминокислотой может быть метионин или лейцин. Недостатком этих гормонов является быстрое разрушение протеазами. У синтетически полученного аналога – даларгина пролонгированное действие обеспечивается благодаря замене стоящего во 2 положении глицина на D-аланин. Напишите первичную структуру даларгина.
12. В результате кислотного гидролиза было установлено, что пептид состоит из 3 аминокислот: гли, глу и цис. При проведении реакции Сенджера было получено динитропроизводное глутамата, а при действии карбоксипептидазы – глицин. Напишите первичную структуру пептида, укажите его химическое и тривиальное название.
13. Широкое применение, особенно в пищевой промышленности, в качестве заменителя сахара получил искусственно синтезирован-ный (генноинженерный синтез) дипептид, состоящий из L-изо-меров аспарагиновой кислоты и метилового эфира фенилаланина – аспартам. Аспартам в сотни раз слаще сахара, легко распадается в организме на 2 аминокислоты, абсолютно безвреден, поэтому рекомендован в качестве заменителя сахара больным диабетом. Напишите первичную структуру пептида, укажите его название.
14. Какие биохимические механизмы лежат в основе поговорки «белены объелся»?
II. Ферменты
15. Одним из препаратов, используемых для лечения лейкозов, является 5-F-урацил. Чем обусловлен его терапевтический эффект?
16. Одно из самых сильных отравляющих веществ – ЗАРИН, является фторорганическим соединением, его действие аналогично действию ДИПФФ. Ингибиторами каких ферментов являются фторорганические соединения такого типа? На чём основано нервнопаралитическое действие ЗАРИНА? Напишите схему взаимодействия ЗАРИНА с ферментом.
17. На чём основано действие инсектицидов?
18. На чём основано фармацевтическое действие аспирина?
19. Чем обусловлен антибактериальный эффект сульфаниламидных препаратов?
20. Почему при лечении падагры назначают аллопуринол?
21. На чём основано применение аспарагиназы при онкологических заболеваниях (например, при лечении лейкозов)?
22. Какие ферменты определяют у пациента при подозрении на инфаркт миокарда?
23. С какой целью у пациента с жалобами на резкую боль в груди определяют в крови количество и соотношение изоферментов КК?
24. На рисунке изображены энзимограммы общей активности КК, КК-МВ и изоферментов ЛДГ. Укажите, какой биохимический показатель соответствует цифре на графике?
25. У трёх из обследованных в группе малышей, бывших в контакте с воспитательницей, заболевшей инфекционным гепатитом, коэффи-циент Де Ритиса был равен 0,6. О чём это говорит?
26. Для лечения длительно не заживающих ран используют мази, в состав которых входят трипсин, гиалуронидаза и другие протеоли-тические ферменты. На чём основано их лечебное действие?
27. Каков механизм действия мевакора, закора, липостата и других подобных соединений при лечении атеросклероза?
III. Нуклеиновые кислоты. Биосинтез белка
28. Почему при дифтерии нарушен синтез белков?
29. В чём сходство и различие посттрансляционных изменений при биосинтезе гемоглобина, инсулина и коллагена?
30. Хороший результат при лечении вирусной инфекции даёт интерферон. На чём основано его действие?
31. При отравлении бледной поганкой до 50 % пациентов погибает. Чем обусловлена столь высокая токсичность этого гриба?
32. В клетке имеется несколько десятков тРНК и несколько десятков тысяч разных мРНК. Чем обусловлено такое различие в количестве молекул этих РНК?
IV. Биоэнергетика
33. Царь Митридат (Крымское царство) систематически принимал небольшие дозы ядов, чтобы избежать острого отравления. На чём основан «эффект Митридата»?
34. В суспензию митохондрий добавили малат и АДФ. Как будут изменяться концентрации этих веществ при инкубации? Какие продукты из них образуются, какие ферменты катализируют эти реакции?
35. В суспензию митохондрий добавили малат, АДФ и динитрофенол. Как будет изменяться концентрация веществ при инкубации? Каков коэффициент P/O, изменится ли температура в среде?
36. Почему для янтарной кислоты коэффициент P/O равен 2?
37. Увеличение концентраций каких веществ в митохондриях ускорит реакции ОПК: а) пируват; б) НАД·Н+Н+; в) АДФ; г)Ca2+;
д) цитрат?
38. Увеличение концентрации каких веществ в митохондриях снизит потребление О2: а) НАД+; б) НАД·Н+Н+; в) Ca2+; г) пируват;
д) АТФ?
39. Почему становится жарко человеку, занимающемуся усиленной физической работой?
V. Обмен углеводов
40. Как отличается обмен углеводов у 2 студентов, возвратившихся домой, если один поужинал и читает, а другой отказался от ужина и пробежался в течение 20 мин?
41. С чем связано возникновение боли в мышцах после выполнения тяжёлой физической работы и почему она через некоторое время исчезает?
42. Для чего и как определяют толерантность к глюкозе?
43. Чем вызвана и как проявляется непереносимость молока?
44. Почему возникает галактоземия?
45. В сперматозоидах одним из энергетических субстратов является фруктоза. Напишите основные реакции включения фруктозы в общие метаболические процессы.
46. Почему при остром алкогольном отравлении наблюдается гипогликемия?
47. Почему при отравлении небольшими дозами метанола для облегчения состояния пострадавшему дают этиловый спирт?
48. Больному с диагнозом «сахарный диабет» был назначен инсулин. Первая инъекция гормона вызвала слабость, холодный пот, мышечную дрожь и затем потерю сознания. Объясните биохимический механизм этого состояния.
49. Коэффициент Покровского у пациента превысил 80%. О чём это говорит?
VI. Обмен липидов
50. Какие различия в обмене холестерола у вегетарианцев и людей, в рационе которых много мяса, яиц и молока?
51. Сколько высокоэргических связей необходимо для биосинтеза 1 молекулы дипальмитилфосфатидилэтаноламина из пальмитиновой кислоты, глюкозы и серина?
52. На сколько будет отличаться выход АТФ при окислении олеиновой кислоты по сравнению со стеариновой?
53. Почему при заболеваниях, сопровождающихся жировой инфильтрацией печени, в качестве лекарственного препарата назначают метионин?
54. Человек получил 250 г углеводов за один приём пищи и в течение 2 часов не совершал физической работы. Какой процесс (синтез или распад жирных кислот) будет активизироваться в жировой ткани через 1,5-2 часа после еды? Какой гормон стимулирует этот процесс? Изобразите схему метаболического пути превращения глюкозы.
VII. Обмен простых белков и аминокислот
55. Содержание аммиака в крови при токсикозах беременности может возрастать в 10-15 раз. На чём основано применение глутаминовой кислоты в таких случаях?
56. В печени происходит метаболизм глютаминовой кислоты, меченной по второму атому углерода (14С) и атому азота (15N). Обнаружатся ли метки и в каком положении в мочевине, сукцинате, цитруллине, орнитине и аспартате?
57. Кошкам, голодавшим в течение 12 часов, дали смесь аминокислот, содержащую все аминокислоты, за исключением аргинина. Через 2 часа содержание аммиака в крови возросло до 140 мкг/л и появились клинические симптомы гипераммониемии (кома, судороги). В контрольной группе животных, получавших полную смесь аминокислот, симптомов не наблюдалось. Почему отсутствие аргинина привело к гипераммониемии? Напишите уравнение реакции, скорость которой снижается в отсутствие аргинина. Можно ли аргинин заменить орнитином?
58. Как можно определить, не являются ли супруги носителями гена фенилкетонурии?
59. Какой метаболический процесс нарушен, если в крови повышается содержание аммиака и пиримидиновых азотистых оснований?
60. Почему при гипераммониемии I и II типа развивается оротацидурия?
61. Почему при болезни Гирке у пациентов в 50% случаев развивается подагра?
62. Пациентам, страдающим эпилепсией, нередко назначают глутамат. Для чего?
VIII. Матричные синтезы. Система репарации
63. В результате действия активного химического соединения оказались отщеплёнными азотистые основания от обоих нуклеотидов пары Г…Ц ДНК. Могут ли репарирующие системы исправить такое повреждение?
64. Напишите схему репликативной вилки, укажите: 3’- и 5’-концы матричных цепей ДНК; 3’- и 5’-концы вновь синтезируемых фрагментов; лидирующую и отстающую цепи.
IX. Биохимия крови
65. Известен наследственный дефект, связанный с мутацией гена, ответственного за синтез альбумина, что приводит к почти полному отсутствию этого белка в плазме крови. Какие функции утрачиваются в результате анальбуминемии?
66. У новорожденного содержание билирубина в крови повышено (за счёт непрямого билирубина), кал интенсивно окрашен (за счёт повышения количества стеркобилина). В моче билирубин не обнаруживается. О каком заболевании идёт речь? Напишите схему образования прямого билирубина.
67. Воспалительные заболевания почек сопровождаются альбуминурией и снижением концентрации альбумина в крови (гипоальбуминемия) до 1 г/л. При этом у больных наблюдаются выраженные отёки. Объясните, почему нефрозы сопровождаются выраженными отёками?
68. Почему при отравлении «печёночными» ядами, циррозе и резекции печени снижается содержание фибриногена в крови?
ТЕХНОЛОГИЧЕСКАЯ КАРТА ПО КУРСУ «БИОХИМИЯ»
| № неде-ли | ЛАБОРАТОРНЫЕ работы | ПРАКТИЧЕСКИЕ занятия | ЛЕКЦИИ | ||||||
| № / тема | час | № / тема | час | тема | час | ||||
| 2-й семестр | |||||||||
| - | - | 1. Методы исследования в биохимии | Раздел 1. Введение. Строение, классификация и функции белков и аминокислот | ||||||
| 1. Цветные реакции на белки | 2. Контрольная работа по теме «Аминокислоты: строение и биологическая роль» | Раздел 1. Функционирование белков. Полиморфизм. | |||||||
| 2. Растворимость и реакции осаждения белков | 3. Строение, функции, классификация и физико-химические свойства белков | Раздел 1. Новое о функциях некоторых белков | |||||||
| 3. Количественное определение белка в сыворотке крови биуретовым методом | 4. Строение, функции, классификация и физико-химические свойства белков | Раздел 12. Гемоглобин: строение, функции, обмен и его нарушения | |||||||
| 4. Определение концентрации гемоглобина в крови | 5. Коллоквиум по теме «Строение, функции, классификация и физико-химические свойства белков» | -“- | |||||||
| - | 6. Строение, разнообразие форм и функции гемоглобина. Обмен и нарушения Hb | Раздел 2. Ферменты: строение, активный центр, механизм действия | |||||||
| 5. Ознакомление с действием некоторых ферментов | 7. Номенклатура и классификация ферментов | Раздел 2. Физико-химические свойства ферментов | |||||||
| 6. Изучение свойств ферментов | 8. Контрольная работа по теме «Номенклатура и классификация ферментов» | Раздел 2. Ферменты: регуляция активности, применение в медицинской практике | |||||||
| 7. Определение активности аминотрансфераз в сыворотке крови по методу Кинга | 9. Коллоквиум по теме «Строение, механизм действия, классификация и свойства ферментов» | Раздел 6. Введение в обмен веществ. Биоэнергетика. Состав, строение и структурная организация дыхательной цепи | |||||||
| 8. Количественное определение аскорбиновой кислоты в пищевых продуктах и моче | 10. Классификация, особенности метаболизма витаминов. Строение и биологическая роль жирорастворимых витаминов | Раздел 6. Окислительное фосфорилирование. Регуляция БО и ОФ. | |||||||
| - | - | 11. Строение и биологическая роль водорастворимых витаминов. Витаминоподобные соединения. | Раздел 6. Внемитохондриальное окисление. АФК: образование, значение, токсичность. | ||||||
| - | - | 12. Биологические мембраны: строение, функции, транспорт веществ через мембрану | Раздел 6. Общие пути катаболизма (окислительное декарбоксилирование ПВК и Цикл трикарбоновых кислот) | ||||||
| - | - | 13. Биологические мембраны: строение, функции, передача сигнала | - | ||||||
| - | - | 14. Введение в обмен веществ. Биоэнергетика | - | - | |||||
| - | - | 15. Общие пути катаболизма | - | - | |||||
| 16-17 | Отработка лабораторных занятий | 16. Итоговое занятие (за 2-й семестр) | - | - | |||||
| Всего за семестр* | |||||||||
| 3-й семестр | |||||||||
| 9. Глюкозооксидазный метод определения глюкозы в биологических жидкостях | 17. Строение, классификация и функции углеводов | Раздел 7. Строение, классификация и биологическая роль углеводов. Переваривание углеводов | |||||||
| 10. Определение толерантности к сахарной нагрузке | 18. Внутриклеточный метаболизм гликогена и глюкозы | Раздел 7. Внутриклеточный метаболизм гликогена и глюкозы | |||||||
| - | 19. Обмен углеводов | Раздел 7. Обмен галактозы и фруктозы. Нарушения обмена углеводов | |||||||
| - | 20. Коллоквиум по теме «Обмен углеводов» | Раздел 8. Строение, классификация и биологическая роль липидов. Переваривание липидов в ЖКТ и транспорт в крови. | |||||||
| 11. Определение концентрации общего холестерола в сыворотке и плазме крови энзиматическим методом | 21. Строение, классификация и функции липидов. Переваривание липидов и транспорт в организме | Раздел 8. Внутриклеточный метаболизм ТАГ и жирных кислот. Метаболизм кетоновых тел. | |||||||
| - | 22. Обмен ТАГ и жирных кислот. Метаболизм кетоновых тел | Раздел 8. Обмен сфинголипидов и стероидов. Нарушения обмена липидов | |||||||
| - | 23. Коллоквиум по теме «Обмен липидов» | Раздел 9. Обмен белков и аминокислот | |||||||
| 13. Определение количества мочевины в сыворотке крови и моче диацетилмонооксимовым методом | 24. Обмен простых белков и аминокислот | Раздел 9. Обмен аммиака, механизм его токсичности и пути обезвреживания | |||||||
| - | 25. Коллоквиум по теме «Обмен простых белков и аминокислот. Механизм токсичности аммиака и пути его обезвреживания» | Раздел 9. Специфические пути обмена отдельных аминокислот | |||||||
| 14. Определение концентрации мочевой кислоты в биологических жидкостях | 26. Контрольная работа «Специфические пути обмена аминокислот» | Раздел 10. Обмен нуклеотидов и нуклеиновых кислот, нарушения. | |||||||
| - | 27. Строение, функции и обмен нуклеотидов и нуклеиновых кислот» | Раздел 11. Матричные синтезы: общая характеристика, виды, основные этапы, регуляция | |||||||
| - | 28. Матричные синтезы | Раздел 11. Виды повреждения НК. Роль репарации. Характеристика основных видов репарации и нарушения ее функции | |||||||
| 15-16. Количественное определение кальция и фосфора в крови | 29. Биохимия крови | - | - | ||||||
| 17-19. Анализ нормальной и патологической мочи | 30. Биохимия мышечной и нервной ткани | - | - | ||||||
| Ознакомление с современными методами в клинической биохимии (экскурсия в клиническую лабораторию РБ КР) | 31. Биохимия соединительной ткани | - | - | ||||||
| Отработка лабораторных работ | 33. Гормоны. Итоговое занятие | - | - | ||||||
| Всего за 3-й семестр* | |||||||||
| Всего за годовой курс | |||||||||
ОЦЕНКА ДЕЯТЕЛЬНОСТИ СТУДЕНТА ПО БАЛЛЬНО-РЕЙТЕНГОВОЙ СИСТЕМЕ
| Итоги | года | баллы | |||||||
| 2го семестра | выполнено | баллы | |||||||
| % от общего количества | |||||||||
| 1го семестра | выполнено | баллы | |||||||
| % от общего количества | |||||||||
| Критерии оценки | Лекции | Лаборатрный практикум | Посеща-емость | Успева-емость | Самостоятельная работа | Бонусные задания | ИТОГО: | ||
| Практи-ческие занятия |
СПИСОК
использованных учебно-методических материалов
1. Осташкова В. В., Андреев В. П., Нижник Я. П. Биологическая, физическая и коллоидная химия: методические указания к лабораторным работам и контрольные вопросы и задачи для студентов II курса агротехнического факультета специальности «Зоотехния». Петрозаводск: Изд-во ПетрГУ, 2007. 100 с.
2. Яковлева М. Н., Осташкова В. В., Нижник Я. П. Руководство к практическим занятиям по биологической химии: методические указания к лабораторным работам и вопросы для самостоятельной подготовки студентов 2-го курса эколого-биологического факультета. Петрозаводск: Изд-во ПетрГУ, 2007. 112 с.
3. Яковлева М. Н., Осташкова В. В., Чекмасова А. А. Биохимия крови и мочи: методические указания к лабораторным работам для студентов 2-го курса медицинского факультета. Петрозаводск: Изд-во ПетрГУ, 2003. 92 с.
4. Яковлева М. Н., Осташкова В. В. Обмен веществ: методические указания к лабораторным работам по биологической химии для студентов 2-го курса медицинского факультета. Петрозаводск: Изд-во ПетрГУ, 2002. 88 с.
5. Яковлева М. Н., Осташкова В. В., Чекмасова А. А. Методы исследования белков: методические указания к лабораторным работам по биологической химии для студентов 2-го курса медицинского факультета. Петрозаводск: Изд-во ПетрГУ, 2003.
44 с.
6. Федеральный государственный образовательный стандарт высшего профессионального образования по направлению подготовки специальности 060101 «Лечебное дело» (квалификация «специальность», М.,. 2010.
СОДЕРЖАНИЕ
Предисловие ..........................................................................…..…… 3
ГЛАВА I. ЛАБОРАТОРНЫЙ ПРАКТИКУМ……………………… 6
РАЗДЕЛ 1. БЕЛКИ
. 1.1. Состав и свойства белков………………….…………... 6
Работа 1. Цветные реакции на белки ................................................ 6
Работа 2. Растворимость и реакции осаждения белков ………….. 11
1.2. Методы кличественного определения белков ………. 16
Работа 3. Количественное определение белка в сыворотке крови биуретовым методом…………………………………….. 16
Работа 4. Определение концентрации гемоглобина в крови колориметрическим (унифицированным) методом ….. 18
РАЗДЕЛ 2. ФЕРМЕНТЫ …………………………………………… 19
Работа 5. Ознакомление с действием некоторых ферментов ……. 19
Работа 6. Изучение свойств ферментов. Влияние на активность фермента реакции среды и температуры, субстратная специфичность ………………………….…………………. 21
Работа 7. Определение активности аминотрансфераз
в сыворотке крови по методу Кинга ............................….... 23
РАЗДЕЛ 3. ВИТАМИНЫ …………………………………………… 25
Работа 8. Количественное определение аскорбиновой
кислоты в пищевых продуктах и моче ................…....…… 25
РАЗДЕЛ 4. ХИМИЯ И ОБМЕН УГЛЕВОДОВ …….…………….. 28
Работа 9. Глюкозооксидазный метод определения глюкозы
в биологических жидкостях ………………………….…… 28
Работа 10. Определение толерантности к сахарной нагрузке ….... 30
РАЗДЕЛ 5. ХИМИЯ И ОБМЕН ЛПИДОВ …….………………….. 31
Работа 11. Определение концентрации общего холестерола
в сыворотке и плазме крови энзиматическим
методом ………………………………...……………..……. 31
Работа 12. Количественное определение холестерина
| <== предыдущая лекция | | | следующая лекция ==> |
| Тема: Створення програм циклічної структури. | | | Лабораторна робота № 6 |