
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Броуновское движение частиц в растворе
Дата добавления: 2014-10-22; просмотров: 680
|
|
Молекулярно-кинетические:
· Броуновское движение частиц в растворе.
· Осмотическое давление (примерно в тысячу раз меньше давления в истинном растворе с то же массовой долей из-за большого размера коллоидных частиц по сравнению с молекулами и ионами).
· Оседание частиц под действием сил различной природы (седиментация). В медицине скорость оседания эритроцитов используется для диагностики различных заболеваний. В биологии седиментационный анализ используют для оценки размеров частиц. Для ускорения процесса седиментации дисперсные системы подвергают центрифугированию.
Оптические:
· Грубодисперсные системы являются оптически мутными, т.к. линейные размеры частиц больше длины световой волны. Происходит отражение света по законам геометрической оптики.
· В системах, размер частиц в которых не превышает 0,1 – 0,2 длины волны падающего света, наблюдается светорассеивание. Если на коллоидный раствор направить луч света и посмотреть сбоку, то можно увидеть светящийся (опалесцирующий) конус (конус Тиндаля). Явление опалесценции отличает коллоидные растворы от истинных.
Электрокинетические:
· Электрофорез – движение частиц дисперсной фазы в электрическом поле.
· Электроосмос – движение частиц дисперсионной среды в электрическом поле.
Причина электрокинетических явлений – образование двойного электрического слоя (ДЭС) на границе раздела фаз. ДЭС состоит из достаточно прочно связанных с поверхностью дисперсной фазы потенциал-определяющих ионов и эквивалентного числа противоположно заряженных ионов – противоионов, находящихся в дисперсионной среде.
Строение частицы коллоидного раствора (мицеллы).
Мицелла состоит из электронейтрального агрегата, окруженного двойным электрическим слоем. Агрегат может состоять из сотен атомов, ионов, молекул. На агрегате осаждаются потенциалопределяющие ионы. Агрегат и потенциалопределяющие ионы образуют ядро мицеллы. На слое потенциалопределяющих ионов адсорбируются противоионы. Строение мицеллы представлено на схеме:
{m[AgCl] nCl- (n-х)K+}х- хК+
 агрегат ПОИ ПИ ПИ
агрегат ПОИ ПИ ПИ
ядро мицеллы диффузионный слой
 |
адсорбционный слой
 |
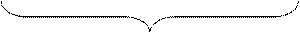 гранула
гранула
мицелла
где
m - число формульных единиц в агрегате
ПОИ – потенциалопределяющие ионы
n - число ПОИ
ПИ – противоионы,
(n-x) – число ПИ в адсорбционном слое
x - число ПИ в диффузионном слое
Эта мицелла может быть получена конденсационным методом, путём реакции ионного обмена между нитратом серебра и хлоридом калия (в избытке хлорида калия). Если в избытке взят нитрат серебра, то происходит смена потенциалопределяющего иона и изменение заряда гранулы. (См. схему мицеллы ниже)
{m[AgCl] nAg+ (n-х)NO3- }х+ х NO3-
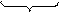 агрегат ПОИ ПИ ПИ
агрегат ПОИ ПИ ПИ
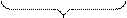 | 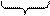 | ||
ядро мицеллы диффузионный слой
 |
 адсорбционный слой
адсорбционный слой
 гранула
гранула
мицелла
Устойчивость дисперсных систем
Дисперсные системы в отличие от истинных растворов являются термодинамически неустойчивыми, т.е. они не могут длительное время сохранять все параметры системы без обмена веществом и энергией с внешней средой. Седиментационная устойчивость – это устойчивость частиц к оседанию под действием силы тяжести. Грубодисперсные системы являются седиментационно неустойчивыми. Агрегативная устойчивость – это способность дисперсных систем сохранять размер частиц и их индивидуальность. В агрегативно неустойчивых системах происходят процессы укрупнения частиц (коагуляция). Коагуляции препятствуют тонкие прослойки растворителя (гидратные оболочки в водных растворах) и электрокинетический потенциал (ζ-потенциал) частиц. Знак его заряда определяется зарядом гранулы, а величина – толщиной диффузного слоя. При сжатии диффузного слоя, например, вследствие увеличения концентрации электролитов в дисперсионной среде ζ-потенциал уменьшается по абсолютному значению. Большое значение имеет процесс разрушения коллоидных систем под действием электролита. В соответствии с правилом Шульце- Гарди коагулирующая способность электролита возрастает с увеличением заряда коагулирующего иона. Коагулирующим действием обладает ион, заряженый одноимённо с противоионом.
Лабораторная работа: Получение неорганических золей.
Цель работы: Закрепление знаний о способах получения дисперсных систем и строении мицеллы неорганического золя.
Опыт №1. Получение золя иодида серебра. В пробирку налить 1 мл KI и добавить несколько капель AgNO3. Написать строение мицеллы, указать все составные части.
Опыт №2 Получение золя гидроксида железа (III). В пробирку налить 1 мл FeCl3 и добавить несколько капель NaOН. Написать строение мицеллы, указать все составные части.
Тесты для самопроверки
1. Агрегатом мицеллы, образующейся в ходе реакции
BaCl2 + K2SO4 → 2KCl + BaSO4 ↓ является:
А. BaCl2
Б. K2SO4
В. KCl,
Г. BaSO4
2. Потенциалопределяющим ионом для мицеллы, поучаемой в ходе реакции
BaCl2 + Н2SO4 → 2KCl + BaSO4 ↓, при избытке Н2SO4 является
А. Ba2+
Б. Cl-
В. SO42-
Г. Н+
3. Вещество в коллоидном состоянии:
А. быстро осаждается
Б. очень медленно осаждается
В. не взаимодействует с другими веществами
Г. легко переходит в газообразное состояние
4. Ион, находящегося в избытке вещества, обладающий сродством к ядру мицеллы и адсорбирующийся на его поверхности, называется:
А. дисперсионным
Б. ядерным
В. коагулирующим
Г. потенциалопределяющим
5. Потенциалопределяющим ионом для мицеллы, поучаемой в ходе реакции
BaCl2 + Н2SO4 → 2KCl + BaSO4 ↓, при избытке BaCl2 является:
А. SO42-
Б. Cl-
В. Н+
Г. Ba2+
6. Заряд гранулы золя, полученного при взаимодействии избытка сульфата меди с сероводородом, определяется зарядом…
А. сульфат-иона
Б. гидросульфид-иона
В. иона меди
Г. иона водорода
7. Дисперсная система, состоящая из двух взаимно нерастворимых или ограниченно растворимых жидкостей, называется:
А, эмульсия
Б. золь
В. суспензия
Г. гидрозоль
8. Коллоидная частица (гранула), образующаяся согласно уравнению реакции
ВаСl2+ H2SO4(изб) = BaSO4 + 2KCl, имеет заряд:
А. положительный
Б. нулевой
В. частично положительный
Г. отрицательный
9. Установите соответствие:
А. жидкая дисперсная фаза в газообразной дисперсионной среде
Б. жидкая дисперсная фаза в жидкой дисперсионной среде
В. твердая дисперсная фаза в жидкой дисперсионной среде
Г. жидкая дисперсная фаза в твердой дисперсионной среде
1. гель
2. пена
3. суспензия
4. аэрозоль
5. эмульсия
10. Максимальным коагулирующим эффектом для мицеллы с агрегатом Ca3(PO4)2 в избытке CaCl2 обладают ионы:
А. Ca2+ Б. HS- В.SO42- Г.Al3+
Домашнее задание: Подготовиться к экспресс-контролю по строению мицелл. Проработать теорию по теме «Органические дисперсные системы». Разобрать ситуационные задачи («Задачник по общей и коллоидной химии») стр. 20-23 № 8,10,11, 12, 17, 21, 34, 44, 51.
www.td-megastyle.ru
| <== предыдущая лекция | | | следующая лекция ==> |
| Геометрична | | | Аналіз одномірного руху частинки в потенціальному полі сил |