
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
Зміст античної гімнастики
Дата добавления: 2015-03-11; просмотров: 784
|
|
Таких реакций большинство. Составим кинетические уравнения прямой и обратной реакций.
uпр = k1·cH2·cJ2
uобр = k2·c2HJ
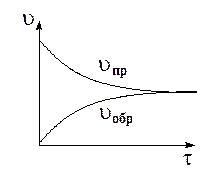 В обратимых реакциях скорость прямой и обратной реакций по-разному изменяются с течением времени. Так, в начальный момент времени скорость прямой максимальна, а скорость обратной реакции практически равна 0, т.к. продукты еще не образованы, а концентрация исходных веществ максимальна. С течением времени скорость прямой реакции будет убывать, а скорость обратной реакции увеличиваться пока не наступит их равенство.
В обратимых реакциях скорость прямой и обратной реакций по-разному изменяются с течением времени. Так, в начальный момент времени скорость прямой максимальна, а скорость обратной реакции практически равна 0, т.к. продукты еще не образованы, а концентрация исходных веществ максимальна. С течением времени скорость прямой реакции будет убывать, а скорость обратной реакции увеличиваться пока не наступит их равенство.
Состояние системы, при котором скорость прямой реакции равна скорости обратной называется химическим равновесием .
uпр = uобр
В условиях равенства скоростей, концентрации исходных веществ и продуктов реакции не изменяются, остаются постоянными и являются равновесными.
Тогда, можно записать k1·cH2·cJ2= k2·c2HJ
Для количественной характеристики состояния равновесия введен безразмерный параметр – константа равновесия. Она равна отношению констант скоростей прямой и обратной реакций.
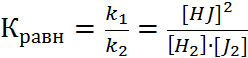
Константа химического равновесия обратимого процесса прямо пропорциональна произведению концентраций продуктов реакции и обратно пропорциональна произведению равновесных концентраций исходных веществ, возведенных в степень равную их стехиометрическим коэффициентам.
Кх.р. зависит от природы реагентов и температуры, но не зависит от концентраций и наличия катализатора.
Значение константы определяет преимущество протекания одной из противоположных реакций:
Если К > 1, то в системе выше содержание продуктов, т.е. преимущественно идет прямая реакция. Если К < 1, то в системе выше концентрация исходных веществ и преимущество имеет обратная реакция.
Между константой равновесия и энергией Гиббса существует математическая зависимость:
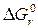 = – RT ln Kравн
= – RT ln Kравн
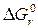 – изменение энергии Гиббса
– изменение энергии Гиббса
R – газовая постоянная
T – температура
Kравн – константа равновесия.
Химическое равновесие носит динамический характер и характеризуется постоянством при неизменности внешних условий.
При изменении концентрации реагентов, температуры и давления скорость одной из реакций может увеличиться, тогда происходит смещение равновесия:
· если возрастает скорость прямой реакции, то равновесие смещается вправо;
· если увеличится скорость обратной реакции, то равновесие смещается влево.
Смещение равновесия определяется принципом Ле-Шателье:

 Если на систему, находящуюся в равновесии оказать внешнее воздействие, то равновесие смещается в сторону той реакции, которая ослабит это воздействие.
Если на систему, находящуюся в равновесии оказать внешнее воздействие, то равновесие смещается в сторону той реакции, которая ослабит это воздействие.
ü Влияние концентрации.
При увеличении концентрации исходных веществ равновесие смещается вправо, а при увеличении концентрации продуктов реакции – влево.
ü Влияние температуры.
При повышении температуры равновесие смещается в сторону эндотермической реакции, а при понижении температуры – в сторону экзотермической реакции.
ü Влияние давления (только для газов и при условии, что количество моль газов исходных веществ и продуктов не равны).
При увеличении давления равновесие смещается в сторону реакции, которая протекает с уменьшением числа моль газов, а при уменьшении давления – в сторону увеличения числа моль газов.
ЭМОЦИОНАЛЬНОЕ РАЗВИТИЕ ВРЕМЕННОГО КОЛЛЕКТИВА
В эмоциональном развитии временного коллектива существует чередование коллективных настроений разной тональности: приятных, жизнерадостных, бодрых, либо неприятных, тревожных, подавленных. Это явление получило название «маятниковый эффект».
Раскачивание эмоционального маятника происходит с определенной периодичностью, создавая эмоциональный ритм жизни коллектива. Эмоциональные подъемы большой силы не задерживаются долго в крайней точке, за ним следует спад настроения. Попытки удержать состояние подъема за счет эмоционально насыщенных ситуаций приводит к самопроизвольному включению механизма «маятника». Происходит привыкание к ярким впечатлениям, ослабляется восприимчивость, эффективность воздействия. В свою очередь, задержка эмоциональных состояний в положении «спад» вызывает симптомы «эмоционального голода».
Радостные переживания, приятные коллективные эмоциональные состояния возникают быстро, тогда как спад настроения происходит постепенно.
В течение смены в жизнедеятельности лагеря имеет место общий эмоциональный ритм, который характеризуется единым циклом с четко просматриваемыми тремя фазами (подъем — спад - подъем).
Каждая фаза имеет свои содержательные особенности:
| <== предыдущая лекция | | | следующая лекция ==> |
| Виховання в Афінах | | | Особливості фізичної культури Стародавнього Риму. |