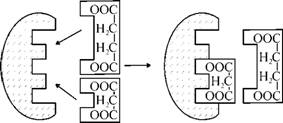
Общая характеристика ферментов.Для живих організмів властива унікальна збалансованість ката-болічних і анаболічних процесів. При цьому в клітинах одночасно здійснюються процеси синтезу, розпаду і взаємоперетворення сотень і тисяч різноманітних речовин, які регулюються численними регуляторними механізмами, що забезпечують постійність внутрішнього середовища організму (гомеостаз). Швидкості хімічних реакцій метаболізму змінюються (регулюються) у залежності від умов середовища і фізіологічного стану. Як уже зазначалося, ферменти, на відміну від інших каталізаторів, належать до каталізаторів із регульованою активністю. За допомогою ферментів можна контролювати швидкість хімічних реакцій, які протікають в організмі. Звідси, їм належить найважливіша роль у процесі регуляції метаболізму. Існує декілька способів такої регуляції. Регуляція активності ферментів може здійснюватися шляхом взаємодії з ними різноманітних біологічних компонентів або сторонніх сполук (наприклад, лікарських засобів, отрут та ін.), які прийнято називати модифікаторами або регуляторами ферментів. Під час дії модифікаторів на фермент хімічні реакції можуть прискорюватися, тоді модифікатори називаються активаторами, або уповільнюватися - у цьому разі їх називають інгібіторами. Існує ряд інших механізмів, які контролюють швидкість метаболічних процесів і активність внутрішньоклітинних ферментів. Абсолютна кількість присутнього в клітині ферменту регулюється швидкістю його синтезу і розпаду. До регулюючих механізмів може бути віднесено і явище так званої компартменталізації - просторове роз'єднання за допомогою мембран ферментів зі своїми субстратами, що дозволяє протікати процесам із протилежною спрямованістю. Ці процеси, наприклад, синтез і розпад, просторово розділені і протікають у різних частинах клітини, у різних субклітинних утвореннях. Так, синтез жирних кислот протікає здебільшого в цитоплазмі, а шляхи розпаду їх зосереджені в мітохондріях. Активування ферментів. Речовини, які підвищують активність ферментів, одержали назву активаторів. Присутність активатора вкрай важлива для ферменту. До активаторів належать кофактори, іони металів, різноманітні модифікатори тощо. Субстрат у певних межах концентрацій є активатором - після досягнення насичених концентрацій субстрату активність ферменту не зростає. Субстрат полегшує формування потрібної конформації активного центру ферменту (індукція), підвищує його стабільність. Досить часто роль активаторів виконують іони металів: вони можуть входити до складу каталітичної ділянки активного центру ферменту; сприяти зв'язуванню субстрату з посадочною ділянкою ферменту (зв'язуючий місток); іноді метали можуть сполучатися не з ферментом, а із субстратом, утворюючи металосубстратний комплекс, на який краще діє фермент; вони можуть діяти непрямим шляхом, зв'язуючи присутній інгібітор тощо. Активація деяких ферментів може здійснюватися шляхом приєднання до алостеричного центру ферменту якої-небудь специфічної модифікуючої групи, що сприяє змінюванню конформації ферменту і його активного центру. Прикладами можуть бути іони хлору, які є активаторами амілази слини; іони водню, які підвищують активність пепсину; жовчні кислоти, які посилюють дію ліпази підшлункової залози; лужна фосфатаза може активуватися катіонами Мц2"1", Мп2+, Са2+, Zn2+, Со2+, №2+. Активація деяких ферментів (особливо тих, що виробляються в шлунково-кишковому тракті) може відбуватися протеолітичним шляхом. Спочатку ферменти виробляються в неактивній формі у вигляді проферментів або зимогенів (попередників ферментів), у яких активний центр замаскований додатковою ділянкою пептидного ланцюга. Внаслідок цього субстрат не може з'єднатися з активним центром. Видалення такої додаткової ділянки може відбуватися різними шляхами і сприяє звільненню активного центру та можливості утворення фермент-субстратного комплексу. Наприклад, проферментом пепсину є пепсиноген, який виробляється в стінках шлунка. Відщеплення від його молекули невеликого пептидного ланцюга за участю соляної кислоти в шлунку призводить до утворення пепсину і формування його активного центру. Профермент трипсиноген утворюється в підшлунковій залозі, до складу його поліпептидного ланцюга входить 229 амінокислотних залишків. У дванадцятипалій кишці під впливом ферменту ентерокінази розривається пептидний зв'язок між 6 і 7 амінокислотними залишками і відщеплюється гек-сапептид. Після відщеплення гексапептиду створюються умови, які сприяють утворенню активного центру ферменту, і трипсиноген перетворюється в трипсин. Цей же процес може здійснюватися аутокаталітично, тобто під впливом уже утворених трипсину і пепсину - у випадку пепсиногену. Синтез ферментів-протеїназ у неактивній формі має певний біологічний сенс, попереджаючи руйнування (самоперетравлювання) клітин органів, у яких утворюються проферменти. Гальмування ферментів. Дія багатьох ферментів може бути загальмована, а в ряді випадків і повністю припинена під час дії певних хімічних речовин - інгібіторів. Інгібітори з тієї чи іншої причини частково або повністю перешкоджають утворенню продуктивного фе рмент-субстратного комплексу. Зокрема, токсичність багатьох отрут для живих організмів, лікувальні ефекти ряду лікарських засобів зумовлені їх інгібіторною дією на ферменти. Серед інгібіторів є як синтетичні речовини, так і природні метаболіти. Для інгібіторів характерна специфічність дії. Необоротну (і неспецифічну) денатурацію ферментів під впливом підвищеної температури, сильних кислот або будь-яких інших факторів зазвичай не розглядають як гальмування. Тому в разі дії денатуруючих факторів правильно говорити не про гальмування, а про інактивування. За допомогою інгібіторів отримують цінну інформацію про специфічність дії ферментів, природу функціональних груп їх активних центрів, про механізм дії і т. ін. Процес гальмування ферментів може бути оборотним і необоротним. Якщо молекула інгібітора викликає стійкі зміни або модифікацію функціональних груп ферменту, то такий тип гальмування називається необоротним. Найчастіше, однак, має місце оборотне гальмування, яке піддається кількісному вивченню на основі рівняння Міхаеліса-Ментен. Необоротне гальмування має місце в тому випадку, коли утворений комплекс фермент-інгібітор практично не дисоціює. Необоротні інгібітори хімічно модифікують важливі для активності функціональні групи ферменту. Звідси, після видалення вільного інгібітору шляхом діалізу, активність модифікованого ферменту не відновлюється. У ряді випадків його активність можна відновити, видаливши приєднаний необоротний інгібітор шляхом проведення відповідної хімічної реакції. Цей процес прийнято називати реактивацією. Прикладом необоротних інгібіторів є диізопропілф-торфосфат (ДІФФ), який інактивує ряд гідролаз (трипсин, хімотрип-син, ацетилхолінестераза та ін.), модифікуючи важливий для активності цих ферментів залишок серину: (сн3)=сн нс=(сн3)2 і і ГнТ-о / + сн2 -*- \_... -нім-сн—со-... о [?] ДІФФ Серинова протеїназа (сн3) = сн нс=(сн3)2 о о 4 / нр + //х о о—сн9 І 2 .. -нїч-сн—со- До інгібіторів синтетичного походження окрім ДІФФ належать, наприклад, фторид натрію, який гальмує фосфатази, фенапролін -металовмісні ферменти, п-хлормеркурібензоат - ферменти, що містять сульфгідрильні (-8Н) групи. Дія таких інгібіторів, як правило, є необоротною. Оборотні інгібітори взаємодіють із ферментом без утворення ковалентних зв'язків. Після інкубації з утворенням комплексу фер-мент-інгібітор, активність ферменту відновлюється під час видалення вільного інгібітора шляхом діалізу. Прикладами оборотних інгібіторів є клітинні метаболіти та їх структурні аналоги, які знижують активність ферментів. За механізмом дії інгібітори ферментів розподіляються на основні типи: конкурентні, неконкурентні, безконкурентні, субстратні або метаболітні, алостеричні. Конкурентне гальмування. Конкурентні інгібітори за будовою подібні до субстрату, вони конкурують із ним за зв'язування з активним центром ферменту. Характерною рисою конкурентного гальмування є те, що ефективність інгібітора залежить від співвідношення концентрацій субстрату й інгібітора. Гальмування відбудеться тоді, коли концентрація інгібітора перевищить концентрацію субстрату. У цьому випадку інгібітор утворює з ферментом інгібітор-ферментний комплекс і виключає фермент із реакції. Але якщо концентрація субстрату буде вищою за концентрацію інгібітора, утворюється фермент-субстратний комплекс і дія інгібітора припиняється. Прикладом конкурентного гальмування є дія малонової та деяких інших дикарбонових кислот на фермент сукцинатдегідрогеназу (СДГ), яка каталізує в організмі перетворення янтарної кислоти (су-кцинату) у фумарову (фумарат).
Малонова кислота є інгібітором даної реакції; у структурному відношенні вона подібна до янтарної кислоти і може конкурувати з останньою за місце в активному центрі ферменту СДГ (рис.41). У цьому випадку СДГ ніби «обманута»: вона замість субстрату янтарної кислоти захоплює його «двійника» (малонову кислоту) і субстрат уже не може розташуватися на контактній ділянці ферменту. Якщо ж навколо ферменту з'явиться багато молекул субстрату (янтарної кислоти), то субстрат ніби витисне інгібітор з активного центру. Оскільки в комплексі фермент - інгібітор через специфічність дії ферменту хімічної реакції не відбувається, активність СДГ виявляється тільки відносно свого субстрату. Навпаки, якщо кількість молекул інгібітора є значною, то субстрату важче проникнути на контактну ділянку ферменту, активність його буде дуже низькою - ферментативна реакція блокується. Сукцинат (субстрат)
Малонат (інгібітор) Е + І -► ЕІ Рис. 41. Схема конкурентного гальмування сукцинатдегідрогенази малонатом Багато фармакологічно активних сполук змінюють протікання метаболічних процесів унаслідок дії на ферменти. Деякі з них виступають у ролі конкурентних інгібіторів, завдяки подібності за структурою до метаболітів. Такі сполуки називають антиметаболітами. Метаболіти - це природні субстрати (хімічні сполуки), які входять у нормі до складу живих організмів (білки, нуклеїнові кислоти, вуглеводи, ліпіди, вітаміни, гормони тощо), а також продукти їх тканинного перетворення - метаболізму. Антиметаболіти - це сполуки, які мають структурну подібність (аналоги) з метаболітами і можуть конкурувати з останніми за фермент. При утворенні комплексу фермент - антиметаболіт ферментативна активність втрачається. Наприклад, сульфаніламідні препарати є антиметаболітами па-раамінобензойної кислоти (ПАБК). ПАБК є метаболітом, який синтезується в мікроорганізмах. ПАБК за структурою подібна до суль-фанілової кислоти, похідні якої складають групу бактеріостатичних, так званих сульфаніламідних препаратів.
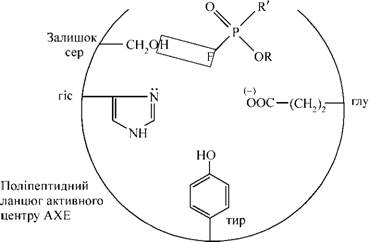
У мікроорганізмах у присутності ПАБК синтезується вітамін- фолієва кислота (назва походить від джерела її виділення з рослин: folium - листок), яка є важливим коферментом ряду ферментів, котрі беруть участь у синтезі нуклеїнових кислот, а відповідно, і білків. Таким чином, фолієва кислота є фактором росту бактерій: стафілококів, пневмококів та ін. Цим забезпечується ріст і розмноження мікроорганізмів. У фолієвій кислоті ПАБК має два замісники: за аміногрупою -гетероциклічне похідне, яке позначимо Rb і за карбоксильною групою - глутамінову кислоту - R2: Під час прийому сульфаніламідних препаратів вони конкурують ---^--------— ^ ~J----1--------—----— "Г----1---------------~----JfJ^ — із ПАБК (структурна подібність) на стадії утворення фолієвої кислоти, оскільки в організмі створюється достатньо висока їх концентрація. Наявність сульфамідної групи в сульфаніламідних препаратах перешкоджає взаємодії ПАБК із глутаміновою кислотою. Таким чином припиняється (блокується) біосинтез фолієвої кислоти. Блокада синтезу фолієвої кислоти в мікроорганізмах призводить до порушення біосинтезу нуклеїнових кислот і білка, внаслідок чого пригнічується ріст і розмноження бактерій. Таким чином, сульфанілова кислота та її К-заміщені аміди є антиметаболітами ПАБК і через антиметаболітне гальмування ферментів зумовлюють бактеріостатичний ефект. Оскільки організм людини не здатний синтезувати вітамін-фолієву кислоту, а отримує її із їжею, він мало чутливий до дії сульфаніламідів у низьких концентраціях. Антиметаболітне гальмування є різновидом конкурентного пригнічення активності ферментів. Конкурентними інгібіторами ферменту ацетилхолінестерази (АХЕ), який каталізує розщеплення ацетилхоліну на холін і оцтову кислоту, є фармакологічні препарати прозерин, фізостигмін та ін. Наприклад, прозерин, маючи у своїй молекулі четвертинний амонієвий азот, легко приєднується (електростатично) до посадочної ділянки активного центру АХЕ (рис.42): Прозерин конкурентно гальмує АХЕ, внаслідок чого накопичується ацетилхолін, який і викликає фармакологічний ефект при певних захворюваннях (міастенії, паралічах, рухових порушеннях після травм, при лікуванні і попередженні атонії кишечника, у тому числі і післяопераційної, і т.ін.). Дія прозерину є оборотною, вона поступово
закінчується, оскільки ацетилхолін витискує інгібітор-прозерин з активного центру і займає своє місце на посадочній ділянці. При цьому утворюється фермент-субстратний комплекс, і каталітична ділянка за участю молекули води вступає в реакцію розщеплення ацетилхоліну (процес гідролізу), що дає можливість згодом уникнути пере-збудження в синапсах через накопичення ацетилхоліну.
Рис.42. Схема конкурентного гальмування ацетилхолінестерази прозерином Вибірково виключаючи той чи інший фермент, можна здійснювати своєрідний аналіз участі конкретного ферменту в обміні речовин. Конкурентне гальмування відкриває можливості для спрямованого пошуку антиметаболітів з метою отримання специфічних фар-мпрепаратів. Неконкурентним гальмуванням називається гальмування, пов'язане із впливом інгібітора на каталітичне перетворення, але не на зв'язування субстрату з ферментом, тому конкурентних відносин між субстратом і інгібітором немає, і ступінь гальмування залежить тільки від концентрації останнього. Неконкурентний інгібітор або зв'язується безпосередньо з каталітичними групами активного центру ферменту, або, зв'язуючись із ферментом поза активним центром, змінює конформацію активного центру і, таким чином, впливає на структуру каталітичної ділянки, заважаючи взаємодії із нею субстрату. Найважливіші неконкурентні інгібітори, утворювані в живих організмах, є проміжними продуктами метаболізму, здатні зв'язуватися зі специфічними ділянками (алостеричний центр) на поверхні деяких ферментів і змінювати при цьому активність їх каталітичних центрів (див. нижче). Прикладом необоротного неконкурентного гальмування може бути дія фосфорорганічних препаратів, подібних до хлорофосу. Фосфорорганічні сполуки (ФОС) блокують необоротно в каталітичній ділянці ферменту ацетилхолінестерази (АХЕ) залишок амінокислоти серину (рис.43); внаслідок чого фермент стає неактивним, відзначається накопичення ацетилхоліну, що призводить до отруєння організму. Тому ФОС застосовують для боротьби зі шкідниками сільського господарства, побутовими комахами та гризунами тощо. У медичній практиці, наприклад, при очних захворюваннях, також застосовуються ФОС (фосфакол, армін, пірофос та ін.), які утворюють стійкий комплекс з АХЕ, і, якщо не застосовувати спеціальні ре-активатори, активність ферменту не відновлюється. Нормальний процес гідролізу ацетилхоліну почнеться знову лише тоді, коли здійсниться біосинтез нової АХЕ. Неконкурентними інгібіторами є, наприклад, ціаніди, які міцно з'єднуються з тривалентним залізом, що входить у каталітичну ділянку гемінового ферменту - цитохромок-сидази. Блокада цитохромоксидази призводить до виключення тканинного дихання, і клітина швидко гине. До неконкурентних інгібіторів ферментів належать іони важких металів та їх органічні сполуки. Тому іони важких металів - ртуті, свинцю, миш'яку тощо - дуже токсичні. Вони блокують, наприклад, БИ-групи, які входять у каталітичну ділянку ферменту (рис. 44, а). Комплекс фермент - інгібітор здатний приєднати субстрат, але перетворення його не відбувається, оскільки каталітичні групи заблоковані. Зняти дію неконкурентного інгібітора надлишком субстрату (як у разі конкурентного гальмування) неможливо. Це можна зробити лише речовинами, які зв'язують інгібітор (реактиваторами - див. рис. 44, б).
Рис.43. Неконкурентне гальмування ФОС ацетилхолінестерази Важкі метали лише в невеликих концентраціях виконують роль неконкурентних інгібіторів. У великих кількостях вони є інактивато-рами, діючи як денатуруючі агенти.
Рис. 44. Схема дії неконкурентного інгібітора (іони ртуті) і механізм реак-тивування ферменту, заблокованого неконкурентним інгібітором У фармакологічній практиці знайшли застосування препарати, що містять ртуть, миш'як, вісмут, які неконкурентно гальмують ферменти в клітинах організму або хвороботворних бактерій, чим і визначається їх той чи інший ефект. Наприклад, під час дії похідних миш'яку сульфгідрильні групи ферментів (наприклад, дегідрогеназ) з'єднуються, утворюючи циклічні неактивні сполуки:
У разі інтоксикації цими препаратами проводиться їх зв'язування або витіснення з комплексу фермент - інгібітор різними реакти-ваторами, або протиотрутами. До них належать, наприклад, БН-вмісні комплексони (цистеїн, унітіол тощо), лимонна кислота, ети-лендиамінтетраоцтова кислота та ін. Безконкурентне гальмування. Спостерігається в тому випадку, коли інгібітор оборотно взаємодіє з ферментом тільки після утворення ЕБ-фермент-субстратного комплексу, тобто безконкурентний інгібітор не поєднується з ферментом у відсутності субстрату. Окрім того, інгібітор полегшує приєднання субстрату, а потім, зв'язуючись, гальмує фермент. Це більш рідкісний вид гальмування. Алостерична регуляція активності ферментів У багатьох суто біосинтетичних реакціях основним типом регуляції швидкості багатоступінчатого ферментативного процесу є ало-стеричне гальмування, зокрема, за типом зворотного зв'язку, коли кінцевий продукт біосинтетичного ланцюга пригнічує активність ферменту, який каталізує ключову реакцію. Як вже зазначалося, деякі ферменти (регуляторні) крім активного центру мають алостери-чний центр для зв'язування алостеричних ефекторів (модифікаторів), які після взаємодії з алостеричним центром роблять фермент або активним, або неактивним. Алостерична регуляція характерна, головним чином, для ферментів, які мають четвертинну структуру. Негативні ефектори гальмують перетворення субстрату, тобто, з'єднуючись з алостеричним центром, змінюють конформацію ферменту і цим перешкоджають формуванню активного центру на ферменті (див. рис. 45, 46).
Рис.45. Схема дії інгібітора, який викликає алостеричну регуляцію: а - приєднання субстрату до активного центру можливе; б - приєднання субстрату до активного центру неможливе Позитивні алостеричні ефектори сприяють формуванню активного центру і таким чином прискорюють ферментативну реакцію (див. рис. 46). Тому їх називають алостеричними активаторами.
Рис.46. Взаємодія алостеричного ферменту із субстратом і ефекторами (схема). а - активний комплекс; б - неактивний комплекс; 1 - активний центр; 2 - алостеричний центр; 3 - субстрат; 4 - позитивний ефектор; 5 - негативний ефектор Алостеричними ефекторами найчастіше виступають різні метаболіти хімічних перетворень в організмі, кофактори, гормони та їх похідні, іони металів та ін. Іноді й субстрат може виконувати функцію алостеричного ефектора. Очевидно, що в таких ферментів активний центр за конфігурацією схожий на алостеричний, але останній не має каталітичної ділянки, чим і відрізняється від активного центру ферменту. Подібні ферменти мають нібито власний контроль. Окремі ферменти мають по декілька алостеричних центрів: одні з них специфичні до алостеричних активаторів, інші - до інгібіторів. Чим більше алостеричних центрів і ефекторів, тим чутливіше реагують ферменти на зміни в обміні речовин. Алостеричні ферменти відіграють важливу роль в обміні речовин клітини. Вони займають «ключове» положення в метаболізмі, оскільки тонко реагують на зміни в обміні речовин і регулюють швидкість проходження речовин системою ферментів. Наприклад, алостерична регуляція проявляється у вигляді гальмування кінцевим продуктом першого ферменту ланцюга. Зовнішньо така регуляція подібна до регуляції за типом зворотного зв'язку і дає змогу контролювати вихід кінцевого продукту, у випадку накопичення якого припиняється дія першого ферменту ланцюга. Існування подібного механізму контролю активності ферментів метаболітами було відкрито в кишечної палички під час дослідження синтезу Ь-ізолейцину. Виявилося, що Ь-ізолейцин, котрий є кінцевим продуктом, вибірково пригнічує активність ферменту треоніндегідратази, яка каталізує першу ланку процесу перетворення Ь-треоніну в Ь-ізолейцин, що нараховує 5 ферментативних реакцій: Е| Е2 Е3 Е4 Е5 Ь-треонін -> В —> С —> D —> Е —> Ь-ізолейцин треонінде- гідратаза ^_І Існування процесу гальмування за типом зворотного зв'язку доведено для всіх живих організмів, і нині він розглядається як один із провідних типів регуляції активності ферментів і клітинного метаболізму в цілому. Виявлено алостеричну регуляцію за допомогою гормонів. Наприклад, інсулін є алостеричним активатором гексокінази, котра бере участь у перетворенні глюкози до глюкозо-6-фосфату в присутності АТФ, а алостеричним інгібітором цього ферменту є гормони надниркових залоз - глюкокортикоїди. Жіночі статеві гормони (естрогени) є алостеричними інгібіторами ферменту глутаматдегідро-генази, який каталізує дезамінування глутамінової кислоти.
Общая характеристика ферментов.
В нормальных физиологических условиях биохимические реакции в организме протекают с высокими скоростями, что обеспечивается биологическими катализаторами белковой природы – ферментами. Их изучением занимается наука энзимология – наука об энзимах (ферментах), специфических белках – катализаторах, синтезируемых любой живой клеткой и активирующих различные биохимические реакции, протекающие в организме. Некоторые клетки могут содержать до 1000 различных ферментов.
|