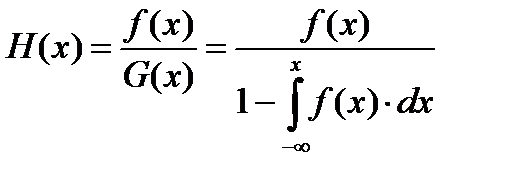Случайные величины и способы их описанияГосударственный бюджет – один из инструментов государственного регулирования экономики, основной финансовый план образования и использования централизованного фонда денежных средств государства. Основными элементами государственного бюджета являются доходы и расходы. К доходам относятся налоги и сборы; к расходам – финансирование экономики, социально-культурных программ, обороны и управления. Случайные величины и способы их описания Случайные величины могут быть: • дискретными (если количество возможных значений конечно); • непрерывными. Характеристикой случайной величины является закон распределения, т.е. связь между возможными значениями случайной величины и соответствующими их вероятностями. Для непрерывных случайных величин используют четыре способа аналитического описания законов распределения: • плотность распределения f(x); • интегральная функция распределения • обратная интегральная функция распределения • функция интенсивности Соответствующие графические зависимости Таким образом, распределения случайных величин Т, Тв, Тс, Тд, задаваемые в любой из возможных форм, являются характеристиками надежности (безотказности, ремонтопригодности, сохраняемости и долговечности). Широко используются в инженерной практике различные численные показатели надежности (показатели безотказности, сохраняемости, долговечности, ремонтопригодности). В качестве таких показателей используются числовые характеристики соответствующих случайных величин. Наиболее широко используются математические ожидания: • среднее время безотказной работы Т; • среднее время восстановления Тв; • среднее время сохраняемости Тс; • средний срок службы Тс.с; • средний ресурс Тр и другие показатели. Приведем основные показатели для восстанавливаемой и невосстанавливаемой аппаратуры.
The heat capacity of a defined system is the amount of heat (usually expressed in calories, kilocalories, or joules) needed to raise the system's temperature by one degree (usually expressed in Celsius or Kelvin). It is expressed in units of thermal energy per degree temperature. To aid in the analysis of systems having certain specific dimensions, molar heat capacity and specific heat capacity can be used. To measure the heat capacity of a reaction, a calorimeter must be used. Bomb calorimeters are used for constant volume heat capacities, although a coffee-cup calorimeter is sufficient for a constant pressure heat capacity. Molar Heat Capacity The amount of heat needed to increase the temperature of one mole of a substance by one degree is the molar heat capacity. It is expressed in joules per moles per degrees Celsius (or Kelvin), JoulesMoles∘C. For example, the molar heat capacity of lead is 26.65 JoulesMolesC, which means that it takes 26.65 Joules of heat to raise 1 mole of lead by °C. Specific Heat Capacity The amount of heat needed to increase the temperature of one gram of a substance by one degree is the specific heat capacity. It is expressed in joules per gram per degree Celsius, JoulesGrams∘C. Because the specific heat of lead is 0.128 JoulesGrams∘C, it 0.128 Joules of heat is required to raise one gram of lead by one °C. Quantity of Heat The quantity of heat is a measurement of the amount of heat is present. The formula of quantity of heat, q, is equal to the mass of substance, m, multiplied with the specific heat and the change in temperature, ΔT. When the mass of substance is multiplied with the specific heat the product is equal to heat capacity, which is donated as C. q=ΔT×C×m Heat capacity, C, can never be negative for a mass or a substance and the specific heat of a substance can never be negative. Thus, if the change in temperature is negative, the initial temperature is more than the final temperature, then quantity of heat must be negative, for a negative number multiplied by a positive number equals a negative number. When the quantity of heat heat is negative heat the system is depleted of its heat; however, if the quantity of heat is positive then the system gains heat. The total heat in a closed system must remain constant, which is represented by the equation qsystem+qsurroundings=0 This means that it is possible to set the quantity of heat of the system equal to the quantity of heat of the surroundings multiplied by negative one, which is used in the first calculation question of lab. Specific Latent Heat There are two types of specific latent heat: vaporization and fusion. The specific latent heat of vaporization is defined as the quantity of heat energy that is necessary to raise one unit of weight (pounds or grams) with no change of temperature in the surroundings. Like the name implies, this specific latent heat quantifies the transfer of energy when a substance's state changes from liquid to gas or from gas to liquid. On the other hand, the specific heat of fusion is the quantity of heat that is necessary to raise one unit of weight without any change in temperature. This specific latent heat quantifies the transfer of energy when a substance's state changes from a solid to a liquid or from a liquid to a solid. Two formulas has be derived from this property: q=m×L and thus L=qm with · qis the amount of heat increase or decrease as the state changes, · m is the mass of the substance present, and · L is the specific latent heat for that substance.
Содержание
1. Молярная теплоемкость 2. Удельная теплоемкость 3. Количество тепла 4. Удельный скрытая теплота 5. Внешние ссылки 6. Ссылки 7. Авторы Теплоемкость определенной системы количество тепла (обычно выражается в калориях, ккал, или Дж), которые необходимы для повышения температуры системы на один градус (обычно выражается в градусах Цельсия или Кельвина). Это выражается в единицах тепловой энергии на температуру градусов. Для помощи в анализе систем, имеющих определенные конкретные размеры, молярная теплоемкость и удельная теплоемкость могут быть использованы. Для измерения теплоемкости реакции, калориметр должен быть использован. Бомба калориметры используются для постоянных мощностей объем тепла, хотя кофе чашка калориметр достаточно для постоянной теплоемкостью давление.
Молярная теплоемкость Количество тепла, необходимое для повышения температуры одного моля вещества на один градус является молярная теплоемкость. Это выражается в джоулях на моль на градусов Цельсия (или Кельвина), JoulesMoles∘C. Например, мольное теплоемкость свинца 26,65 JoulesMolesC, что означает, что она занимает 26,65 джоулей тепла, чтобы поднять 1 моль свинца ° С.
Удельная теплоемкость Количество тепла, необходимое для повышения температуры одного грамма вещества на один градус удельная теплоемкость. Это выражается в джоулях на грамм на градус Цельсия, JoulesGrams∘C. Потому что теплоемкость свинца 0,128 JoulesGrams∘C, это 0,128 джоулей тепла, необходимое для повышения одного грамма свинца на один ° C.
Количество тепла Количество тепла, является измерение количества тепла присутствует. Формула количества тепла, Q, равна массе вещества, т, умноженной с удельной теплоемкости и изменения температуры, & Dgr; t. Когда масса вещества умножается теплоемкости продукт равен теплоемкости, который, как донорской С
Q = & Delta; t × C × м Тепловая мощность, C, никогда не может быть отрицательным для массы или вещества и удельная теплоемкость вещества никогда не может быть отрицательным. Таким образом, если изменение температуры имеет отрицательное значение, начальная температура составляет более конечной температуры, то количество тепла должно быть отрицательным, по отрицательное число умножается на положительное число равно отрицательное число. Когда количество тепла тепла отрицательный тепловой системы истощены своего тепла; Однако, если количество теплоты является положительным, то система получает тепло.
Общий тепловой энергии в замкнутой системе должна оставаться постоянной, которая представлена уравнением
QSystem + qsurroundings = 0 Это означает, что можно установить количество тепла в системе, равном количеству тепла из окружения, умноженное на отрицательное, которое используется в первом расчета вопроса о лаборатории.
Удельный скрытая теплота Существуют два типа конкретной скрытой теплоты испарения: и слияние.Удельная скрытая теплота парообразования определяется как количество тепловой энергии, которое необходимо, чтобы поднять одну единицу веса (фунты или г) без изменения температуры в окружающую среду. Как следует из названия, это удельная скрытая теплота количественно передачу энергии при изменении состояния вещества от жидкости к газу или от газа к жидкости. С другой стороны, удельная теплота плавления количество тепла, которое необходимо, чтобы поднять одну единицу веса без каких-либо изменений в температуре. Это удельная скрытая теплота количественно передачу энергии при изменении состояния вещества от твердого тела к жидкости или от жидкости к твердой. Две формулы была быть получена от этого имущества:
Q = M × L и, таким образом,
L = QM с
QIs величину увеличения тепла или уменьшается в смене состояний м является масса настоящее веществ, и L является удельная скрытая теплота для этого вещества. Переводчик Google для бизнеса –Инструменты переводчикаПереводчик сайтовСлужба "Анализ рынков"
The amount of heat The internal energy of the body can be changed due to the work of external forces. To characterize the change in internal energy in heat exchange introduced a quantity called the amount of heat and is denoted by Q.
The amount of heat - a physical quantity that indicates which energy is transferred as a result of body heat.
In the International System of Units amount of heat, as well as work and energy is the joule: [Q] = [A] = [E] = 1 J.
In practice, still sometimes used off-system unit amount of heat - calorie. 1 cal. J = 4.2.
It should be noted that the term "amount of heat" fails. It was introduced at a time when it was believed that the bodies contained some imponderable, subtle fluid - caloric. Heat exchange process supposedly is that caloric, poured from one body to another, and carries with it a certain amount of heat. Now, knowing the basics of molecular-kinetic theory of the structure of matter, we understand that caloric in bodies no mechanism to change the internal energy of the body is different. However, the force of tradition is great and we continue to use the term introduced based on misconceptions about the nature of heat. However, understanding the nature of heat, you should not completely ignore the misconceptions about it. On the contrary, drawing an analogy between the flow of heat and fluid flow hypothetical caloric amount of heat and the amount of caloric, it is possible in solving certain classes of problems to visualize the processes taking place and correctly solve the problem. In the end, true equations that describe the processes of heat exchange, were at one time obtained on the basis of misconceptions about the caloric as medium heat.
The amount of heat transferred from one body to another, there can be used to heat the body, melting, vaporization, or stand at the opposite process - cooling the body, crystallization, condensation. The heat released during combustion.
Consider in more detail the processes that can occur as a result of heat exchange.
Pour a little water in a test tube and close it with a fuse. Hang the tube to the bars fixed to a tripod, and they brought it under an open flame. Flame tube receives a certain amount of heat and temperature of the liquid in it rises. With increasing temperature the internal energy of the fluid increases. An intensive process of evaporation. Expanding pair liquid perform mechanical work on the expulsion of the plug out of the tube.
Draw another experience with the model guns made from a length of brass tube, which is attached to the trolley. On one side of the tube is tightly closed ebony tube, through which the pin is missing. By stud and tube soldered wires ending terminals, which can be supplied by the lighting network. Model gun thus represents a kind of an electric boiler.
Pour into the barrel of the gun a little bit of water and close the tube with a rubber stopper. Connect the gun to the power supply. Electric current passing through the water heats it. Water begins to boil, which leads to its Rate of evaporation. Vapor pressure increases, and finally, they do work by pushing out a plug of the gun barrel.
Gun, due to the recoil is rolled in the direction opposite to the escape traffic jams.
Both experiences were combined following circumstances. During heating, the liquid in different ways, the temperature of the fluid and, accordingly, its internal energy is increased. To the liquid boiled vigorously and evaporated, it was necessary to continue heating.
Couples fluid due to its internal energy made mechanical work.
Investigate the dependence of the amount of heat required for heating the body of its mass, temperature and kind of substance. To study these dependencies will use the water and oil. (In order to measure the temperature used in the experiment electric thermometer made of a thermocouple connected to a galvanometer mirror. One thermocouple junction is lowered into the vessel with cold water to maintain a constant temperature. The other junction of the thermocouple measures the temperature of the test liquid).
Experience has three series. In the first series is studied for a particular fluid constant weight (in this case - water) dependence of the amount of heat required for heating it from temperature changes. On the number of heat produced fluid from the heater (hotplate) will be judged by the heating time, suggesting that the two are directly proportional relationship. The result of the experiment corresponded to this assumption, it is necessary to ensure steady flow of heat from the heated electric body. For this stove was plugged in advance, so that the beginning of the experiment to the surface temperature is no longer changing. For a more uniform heating of the liquid during the experiment, we stir it with the thermocouple itself. We will fix the thermometer at regular intervals as long as the light spot reaches the edge of the scale.
Conclude that between the amount of heat required to heat the body and change its temperature, there is a direct proportional relationship.
In a second series of experiments we compare the amount of heat required for heating the same fluids having different masses when their temperature change at the same value.
For ease of comparison, the values obtained by the mass of water for the second experiment will take twice less than in the first experiment.
Again will fix the thermometer at regular intervals.
Comparing the results of the first and second experiments, the following conclusions.
Between the mass of a substance and the amount of heat required to heat it, there is a direct proportional relationship.
In a third series of experiments we compare the amount of heat required for heating various fluids of equal mass, changing the temperature of one and the same value.
Will be heated on a hotplate oil with a mass equal to the mass of water in the first experiment. We will fix the thermometer at regular intervals.
Experimental result confirms the conclusion that the amount of heat required for heating the body is directly proportional to its temperature change, and besides, this indicates the amount of heat depending on the kind of substance.
Since the oil used in the experiment, the density of which is less than the density of water and oil for heating to a temperature required minimal amount of heat than hot water, it can be assumed that the amount of heat required for heating the body depends on its density.
To test this hypothesis, we simultaneously heated at the heater constant power equal weight of water, paraffin and copper.
After the same time, the temperature of copper is about 10 times, and the wax is about 2 times higher than the water temperature.
However, copper has a greater wax and a lower density than water.
Experience shows that the quantity which characterizes the rate of change of the temperature of the substances making up the body involved in heat exchange is not density. This value is called specific heat of a substance and is denoted by the letter c.
For comparison, the specific heats of various substances is a special device. The device consists of a rack in which the fine is fixed paraffin plate and strap with missing rods through it. At the ends of the rods reinforced aluminum, steel and brass cylinders of equal mass.
Cylinders to heat the same temperature by immersing them in a container with water, standing on a hot hotplate. We fix the hot cylinders on racks and free them from the mount. Cylinders simultaneously touch the plate and the wax, melting wax, begin to sink into it. The depth of immersion in the cylinders of equal mass paraffinic plate, changing their temperature at the same value is different.
Experience has shown that the specific heat capacity of aluminum, steel and brass are different.
Having done similar experiments with melting solids, vaporization of the liquid, the combustion of the fuel we get the following quantitative relationships.
The amount of heat required for heating the body or cooling the released when it is directly proportional to body weight change and its temperature.
Q = cmΔT. The amount of heat needed to convert liquid to vapor or released its condensation, is directly proportional to the mass of the liquid.
Q = Lm. The amount of heat needed to melt the body or released its crystallization is directly proportional to the mass of the body.
Q = rm. The amount of heat released during the combustion of fuel is directly proportional to its mass.
Q = qm. In all the formula to calculate the amount of heat for various thermal processes are coefficients of proportionality is called the specific values, that is, per unit of other variables. Specific values are characteristics of substances, not bodies.
The specific heat capacity of the substance, what is the amount of heat required for heating or cooling released when 1 kg of a substance by 1 K.
Specific heat of vaporization, melting, combustion indicate the amount of heat required for vaporization, melting or released upon condensation, crystallization, combustion of 1 kg of material.
To get the unit specific values, they must be expressed from the corresponding formulas and the resulting expressions to substitute heat units - 1 J, weight - 1 kg and specific heat - and 1 K.
Obtain units: specific heat - 1 J / kg · K, specific heat of the remaining 1 J / kg.
Количество теплоты Внутренняя энергия тела может изменяться за счет работы внешних сил. Для характеристики изменения внутренней энергии при теплообмене вводится величина, называемая количеством теплоты и обозначаемая Q.
Количество теплоты – это физическая величина, показывающая, какая энергия передана телу в результате теплообмена.
В международной системе единицей количества теплоты, также как работы и энергии, является джоуль: [Q] = [A] = [E] = 1 Дж.
На практике еще иногда применяется внесистемная единица количества теплоты – калория. 1 кал. = 4,2 Дж.
Следует отметить, что термин «количество теплоты» неудачен. Он был введен в то время, когда считалось, что в телах содержится некая невесомая, неуловимая жидкость – теплород. Процесс теплообмена, якобы, заключается в том, что теплород, переливаясь из одного тела в другое, переносит с собой и некоторое количество теплоты. Сейчас, зная основы молекулярно-кинетической теории строения вещества, мы понимаем, что теплорода в телах нет, механизм изменения внутренней энергии тела иной. Однако, сила традиций велика и мы продолжаем пользоваться термином, введенным на основе неверных представлений о природе теплоты. Вместе с тем, понимая природу теплообмена, не следует полностью игнорировать неверные представления о нем. Напротив, проводя аналогию между потоком тепла и потоком гипотетической жидкости теплорода, количеством теплоты и количеством теплорода, можно при решении некоторых классов задач наглядно представить протекающие процессы и верно решить задачи. В конце-концов, верные уравнения, описывающие процессы теплообмена, были в свое время получены на основе неверных представлений о теплороде, как носителе теплоты.
Количество теплоты, передаваемое от одного тела к другому, может идти на нагревание тела, плавление, парообразование, либо выделяться при противоположных процессах – остывании тела, кристаллизации, конденсации. Теплота выделяется при сгорании топлива.
Рассмотрим более подробно процессы, которые могут протекать в результате теплообмена.
Нальем в пробирку немного воды и закроем ее пробкой. Подвесим пробирку к стержню, закрепленному в штативе, и подведем под нее открытое пламя. От пламени пробирка получает некоторое количество теплоты и температура жидкости, находящейся в ней, повышается. При повышении температуры внутренняя энергия жидкости увеличивается. Происходит интенсивный процесс ее парообразования. Расширяющиеся пары жидкости совершают механическую работу по выталкиванию пробки из пробирки.
Проведем еще один опыт с моделью пушки, изготовленной из отрезка латунной трубки, которая укреплена на тележке. С одной стороны трубка плотно закрыта эбонитовой пробкой, сквозь которую пропущена шпилька. К шпильке и трубке припаяны провода, оканчивающиеся клеммами, на которые может подаваться напряжение от осветительной сети. Модель пушки, таким образом, представляет собой разновидность электрического кипятильника.
Нальем в ствол пушки немного воды и закроем трубку резиновой пробкой. Подключим пушку к источнику тока. Электрический ток, проходя через воду, нагревает ее. Вода закипает, что приводит к ее интенсивному парообразованию. Давление водяных паров растет и, наконец, они совершают работу по выталкиванию пробки из ствола пушки.
Пушка, вследствие отдачи, откатывается в сторону, противоположную вылету пробки.
Оба опыта объединяют следующие обстоятельства. В процессе нагревания жидкости различными способами, температура жидкости и, соответственно, ее внутренняя энергия увеличивались. Для того, чтобы жидкость кипела и интенсивно испарялась, необходимо было продолжать ее нагревание.
Пары жидкости за счет своей внутренней энергии совершили механическую работу.
Исследуем зависимость количества теплоты, необходимой для нагревания тела, от его массы, изменения температуры и рода вещества. Для исследования данных зависимостей будем использовать воду и масло. (Для измерения температуры в опыте применяется электрический термометр, изготовленный из термопары, подключенной к зеркальному гальванометру. Один спай термопары опущен в сосуд с холодной водой для обеспечения постоянства его температуры. Другой спай термопары измеряет температуру исследуемой жидкости).
Опыт состоит из трех серий. В первой серии исследуется для постоянной массы конкретной жидкости (в нашем случае – воды) зависимость количества теплоты, необходимого для ее нагревания, от изменения температуры. О количестве теплоты, полученной жидкостью от нагревателя (электрической плитки), будем судить по времени нагревания, предполагая, что между ними существует прямо пропорциональная зависимость. Чтобы результат эксперимента соответствовал этому предположению, необходимо обеспечить стационарный поток тепла от электроплитки к нагреваемому телу. Для этого электроплитка была включена в сеть заранее, так чтобы к началу опыта температура ее поверхности перестала изменяться. Для более равномерного нагрева жидкости во время опыта, будем помешивать ее при помощи самой термопары. Будем фиксировать показания термометра через равные промежутки времени до тех пор, пока световой зайчик не дойдет до края шкалы.
Сделаем вывод: между количеством теплоты, необходимым для нагревания тела и изменением его температуры, существует прямая пропорциональная зависимость.
Во второй серии опытов будем сравнивать количества теплоты, необходимые для нагревания одинаковых жидкостей разной массы при изменении их температуры на одну и ту же величину.
Для удобства сравнения получаемых величин массу воды для второго опыта возьмем в два раза меньше, чем в первом опыте.
Вновь будем фиксировать показания термометра через равные промежутки времени.
Сравнивая результаты первого и второго опытов можно сделать следующие выводы.
Между массой вещества и количеством теплоты, необходимым для его нагревания, существует прямая пропорциональная зависимость.
В третьей серии опытов будем сравнивать количества теплоты, необходимые для нагревания равных масс различных жидкостей, при изменении их температуры на одну и ту же величину.
Будем нагревать на электроплитке масло, масса которого равна массе воды в первом опыте. Будем фиксировать показания термометра через равные промежутки времени.
Результат опыта подтверждает вывод о том, что количество теплоты, необходимое для нагревания тела, прямо пропорционально изменению его температуры и, кроме того, свидетельствует о зависимости этого количества теплоты от рода вещества.
Поскольку в опыте использовалось масло, плотность которого меньше плотности воды и для нагревания масла до некоторой температуры потребовалось меньшее количество теплоты, чем для нагревания воды, можно предположить, что количество теплоты, необходимое для нагревания тела, зависит от его плотности.
Чтобы проверить это предположение, будем одновременно нагревать на нагревателе постоянной мощности одинаковые массы воды, парафина и меди.
Через одно и то же время температура меди оказывается примерно в 10 раз, а парафина примерно в 2 раза выше температуры воды.
Но медь имеет большую, а парафин меньшую плотность, чем вода.
Опыт показывает, что величиной, характеризующей скорость изменения температуры веществ, из которых изготовлены тела, участвующие в теплообмене, является не плотность. Эта величина называется удельной теплоемкостью вещества и обозначается буквой c.
Для сравнения удельных теплоемкостей различных веществ служит специальный прибор. Прибор состоит из стоек, в которых крепится тонкая парафиновая пластинка и планка с пропущенными сквозь нее стержнями. На концах стержней укреплены алюминиевый, стальной и латунный цилиндры равной массы.
Нагреем цилиндры до одинаковой температуры, погрузив их в сосуд с водой, стоящий на горячей электроплитке. Закрепим горячие цилиндры на стойках и освободим их от крепления. Цилиндры одновременно прикасаются к парафиновой пластине и, плавя парафин, начинают погружаться в нее. Глубина погружения цилиндров одинаковой массы в парафиновую пластину, при изменении их температуры на одну и ту же величину, оказывается разной.
Опыт свидетельствует о том, что удельные теплоемкости алюминия, стали и латуни различны.
Проделав соответствующие опыты с плавлением твердых тел, парообразованием жидкостей, сгоранием топлива получаем следующие количественные зависимости.
Количество теплоты, необходимое для нагревания тела или выделяющееся при его охлаждении, прямо пропорционально массе тела и изменению его температуры.
Q = cmΔT. Количество теплоты, необходимое для превращения жидкости в пар или выделяющееся при его конденсации, прямо пропорционально массе жидкости.
Q = Lm. Количество теплоты, необходимое для плавления тела или выделяющееся при его кристаллизации, прямо пропорционально массе этого тела.
Q = rm. Количество теплоты, выделяющееся при сгорании топлива, прямо пропорционально его массе.
Q = qm. Во всех формулах, позволяющих рассчитывать количество теплоты для различных тепловых процессов, стоят коэффициенты пропорциональности, называемые удельными величинами, то есть приходящимися на единицу других величин. Удельные величины являются характеристиками веществ, а не тел.
Удельная теплоемкость вещества показывает, чему равно количество теплоты, необходимое для нагревания или выделяющееся при охлаждении 1 кг вещества на 1 К.
Удельные теплоты парообразования, плавления, сгорания показывают, какое количество теплоты требуется для парообразования, плавления или выделяется при конденсации, кристаллизации, сгорании 1 кг вещества.
Чтобы получить единицы удельных величин, их надо выразить из соответствующих формул и в полученные выражения подставить единицы теплоты – 1 Дж, массы – 1 кг, а для удельной теплоемкости – и 1 К.
Получаем единицы: удельной теплоемкости – 1 Дж/кг·К, остальных удельных теплот: 1 Дж/кг.
|