Правила написания уравнений реакций в ионном виде
Правила написания уравнений реакций в ионном виде
Условия, при которых реакции ионного обмена 1. Если в результате реакции выделяется малодиссоциирующее вещество – вода. Молекулярное уравнение реакции щелочи с кислотой:
Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными. Полное ионное уравнение реакции: K+ + OH– + H+ + Cl– = K+ + Cl– + H2O. Cокращенное ионное уравнение реакции: H+ + OH– = H2O. Молекулярное уравнение реакции основного оксида с кислотой: CaO + 2HNO3 = Ca(NO3)2 + H2O. Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции: CaO + 2H+ = Ca2+ + H2O. Молекулярное уравнение реакции нерастворимого основания с кислотой: 3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2 Полное ионное уравнение реакции:
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением. Молекулярное уравнение реакции амфотерного оксида с кислотой: Al2
|

 Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.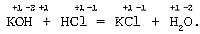
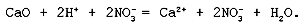
 + 6H2O.
+ 6H2O.



