Общие сведения. 1. Уравнять реакцию: H2O2 + KMnO4 + H2SO4 = O2 + MnSO4 + K2SO4 + H2O.1. Уравнять реакцию: H2O2 + KMnO4 + H2SO4 = O2 + MnSO4 + K2SO4 + H2O. 2. 10 г порошка латуни (сплав меди с цинком) обработали избытком соляной кислоты и получили 1,3 л водорода, измеренного при 180С и 90000 Па. Каков процентный состав сплава? 3. Какое количество миллилитров 0,5 н. раствора сульфата натрия надо прилить к 100 мл 16 % раствора хлорида бария плотностью 1,156 г/см3, чтобы полностью осадить сульфат-ион? 4. Определить рН раствора после смешивания 200 мл 0,5 н. раствора серной кислоты и 300 мл раствора едкого натра с концентрацией 0,3 моль/л.
Методические указания к лабораторным работам по дисциплине «Общая химия»
Лабораторная работа № 1. Исследование комплексных соединений Цель работы: познакомиться с методами получения комплексных соединений и их свойствами. Общие сведения Комплексными называют соединения, в структуре которых можно выделить центральный атом – акцептор электронов, находящийся в донорно-акцепторной связи с определенным числом доноров-лигандов. Лигандами могут быть как ионы, так и нейтральные молекулы. Центральный атом и лиганды образуют внутреннюю сферу комплексного соединения, которую при записи формулы выделяют квадратными скобками. Внутренняя сфера часто имеет заряд, который компенсируют противоположно заряженные ионы, располагающиеся во внешней сфере. Внешнесферные ионы не имеют связей с центральным атомом, а образуют ионные связи с комплексными ионами. Поэтому в полярных растворителях комплексные соединения диссоциируют на комплексный и внешнесферный ионы, например:
В первом случае в растворе практически отсутствуют цианид-ионы, поэтому соединение не относится к сильнодействующим ядам. Второе соединение будет давать в растворе качественную реакцию на хлорид-ион (образование осадка AgCl) и не будет давать осадок BaSO4 с растворами солей бария. Первое соединение является анионным комплексом, поскольку содержит в своей структуре и образует при диссоциации в растворе комплексные анионы. Второе соединение является катионным комплексом. Существуют и нейтральные комплексы, у которых внутренняя сфера не имеет заряда, соответственно, внешняя сфера отсутствует, например: [Pt(NH3)2Cl2]. При записи формулы комплексного соединения его составные части располагают в порядке возрастания электроотрицательности. На первом месте помещают внешнесферные катионы, затем центральный атом, далее нейтральные лиганды, лиганды-анионы и в конце формулы записывают внешнесферные анионы. Читают формулу в английском языке слева направо, но в русском – справа налево. При этом название внутренней сферы произносят в одно слово, используя соединительную гласную «о», название комплексного аниона заканчивают суффиксом «-ат-». Молекулы воды в качестве лигандов обозначают приставкой «аква-», а молекулы аммиака – приставкой «аммино-». Степень окисления центрального атома при записи названия комплекса указывают римской цифрой в круглых скобках, заряды ионов – арабскими цифрами. Например, первое из приведенных выше комплексных соединений мы назовем: гексацианоферрат (III) калия, второе – хлорид сульфатотетраамминокобальта (III), третье – дихлородиамминоплатина (II). Число связей, образуемых лигандом с центральным атомом, называют дентатностью лиганда. Например, CN-, NH3 – монодентатные лиганды, а сульфат-ион – бидентатный лиганд. Число связей, образуемых центральным атомом с лигандами, называют координационным числом. Если лиганды монодентатные, координационное число равно числу лигандов, например, координационное число железа в K3[Fe(CN)6] равно 6, координационное число платины в [Pt(NH3)2Cl2] равно 4. Однако в [Co(NH3)4(SO4)]Cl лигандов пять, а координационное число кобальта равно 6, поскольку сульфат-ион бидентатен.
|

 ;
;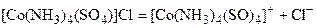 .
.


