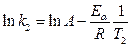Закон действующих масс)Скорость химической реакции прямо пропорциональна действующим массам реагентов, т.е. концентрациям реагирующих веществ. 30) коэффициент пропорциональности k (константа скорости реакции), который показывает какая доля от общего числа соударений молекул веществ А и В приводит к химической реакции. Константа скорости химической реакции может зависеть от природы реагирующих веществ, температуры, давления, наличия примесей и т.д., но не зависит от концентрации реагентов. Для реакции уравнение скорости реакции имеет вид
В общем случае для реакции двух веществ уравнение скорости реакции записывается следующим образом
Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л. (например, 31) Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. ]Реакция нулевого порядка
График зависимости концентрации реагента A в реакции A → B от времени для нулевого порядка реакции Кинетическое уравнение имеет следующий вид: V0 = k0 Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения. ]Реакция первого порядка
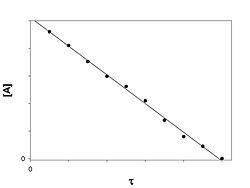
График зависимости концентрации реагента A для первого порядка реакции Кинетическое уравнение реакции первого порядка:
Приведение уравнения к линейному виду даёт уравнение:
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени: k1 = − tgα Период полупревращения:
32) Реакция второго порядка
График зависимости концентрации реагента A для второго порядка реакции Для реакций второго порядка кинетическое уравнение имеет следующий вид:
или
В первом случае скорость реакции определяется уравнением
Линейная форма уравнения:
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени: k2 = − tgα
Во втором случае выражение для константы скорости реакции будет выглядеть так:
Период полупревращения (для случая равных начальных концентраций!):
33) Порядок реакции - это число, равное сумме показателей степени концентрации реагирующих веществ в уравнении скорости реакции.
(где k - константа скорости реакции; n, m - некоторые числа, которые называют порядком реакции по веществу A и B, соответственно (в общем случае эти числа могут отличаться от стехиометрических коэффициентов n и m в уравнении реакции).
Сумма показателей степеней ( Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой.
34) период полупревращения t1/2– время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной.
Период полупревращения (для случая равных начальных концентраций!): 35) («осаждение – растворение», «окисление – восстановление», «диссоциация – ассоциация» и т.д.) Для обратимой реакции
· скорость прямой реакции
· скорость обратной реакции
где k2 - константа скорости обратной реакции;
скорость прямой реакции скорость обратной реакции
Наступает момент, когда скорость прямой реакции становится равной скорости обратной реакции (химическое равновесие)
(Состояние химического равновесия характеризуется тем, что концентрации исходных реагентов и конечных продуктов реакции при данных T и P остаются постоянными.)
(при установлении равновесия в единицу времени образуется такое количество вещества D и C, какое в это же время распадается с образованием веществ A и B. Химическое равновесие является динамическим. (В момент равновесия химическое взаимодействие не прекращается, а продолжает идти с одинаковой скоростью в обоих направлениях).
K - константа равновесия реакции
(Константа химического равновесия K представляет характерную для каждой обратимой реакции величину, которая определяется природой реагирующих веществ, не зависит от их концентрации и меняется с изменением температуры и давления).
Если обратимая химическая реакция
то
KС - константа химического равновесия, выраженная через молярные концентрации (Константу химического равновесия можно выразить и через другие величины). 36) Цепные реакции - реакции, состоящие из ряда взаимосвязанных стадий, когда частицы, образующиеся в результате каждой стадии, генерируют последующие стадии. Особенности 1.Чрезвычайно чувствительны к ничтожно малым количествам определенных веществ 2.Быстро обрываются при проведении реакции в узких трубках Как правило, цепные реакции протекают с участием свободных радикалов. Для всех цепных реакций характерны следующие стадии (например, реакция образования хлороводорода) H2 + Cl2 ® 2HCl 1. Зарождение цепи (инициация): Сl2 + hν ––> 2 Сl• 2. Развитие цепи: Н2 + Сl• ––> НСl + Н• Н• + Сl2 ––> НСl + Сl• Стадия развития цепи характеризуется числом молекул продукта реакции, приходящихся на одну активную частицу – длиной цепи. 3. Обрыв цепи (рекомбинация): Н• + Н• ––> Н2 Сl• + Сl• ––> Сl2 Н• + Сl• ––> НСl неразветвленная цепная реакция, в которой на одну прореагировавшую активную частицу приходится не более одной вновь возникающей. Разветвленными называют цепные реакции, в которых на каждую прореагировавшую активную частицу приходится более одной вновь возникающей, т.е. число активных частиц в ходе реакции постоянно возрастает. Примером разветвленной цепной реакции является реакция взаимодействия водорода с кислородом: 1. Инициация: Н2 + О2 ––> Н2О + О• 2. Развитие цепи: О• + Н2 ––> Н• + ОН• Н• + О2 ––> О• + ОН• ОН• + Н2 ––> Н2О + Н• 37) ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКИХ РЕАКЦИЙ ОТ ТЕМПЕРАТУРЫ Скорость любой химической реакции увеличивается при увеличении температуры, если не происходит вторичных изменений реагентов (например, денатурация фермента). Наиболее существенным фактором, определяющим характер влияния температуры на скорость реакции, является кинетическая энергия молекул реагентов. Правило Вант-Гоффа заключается в том, что при нагревании на 10оС скорость большинства химических реакций увеличивается в 2-4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом:
Гораздо более точным является уравнение Аррениуса, описывающее температурную зависимость константы скорости:
A - предэкспоненциальный множитель, который не зависит от температуры, а определяется только видом реакции; EA - энергия активации (пороговая энергия) (если энергия сталкивающихся частиц меньше EA, то при столкновении реакция не произойдет, если энергия превышает EA, реакция произойдет. Энергия активации не зависит от температуры)
Графически зависимость k(T):
При низких температурах химические реакции почти не протекают: k(T) При очень высоких температурах константа скорости стремится к предельному значению: k(T)
После интегрирования уравнение Аррениуса
Экспериментальные данные удобно представлять в координатах «ln k - 1/T», тогда тангенс угла наклона будет равен ( (легко найти энергию активации реакции).
Энергию активации можно определить, измерив константу скорости при двух температурах.
вычтем одно из другого и получим
Для различных реакций энергия активации меняется примерно в пределах 40-300 кДж/моль. 38) Теория активных столкновений (теория молекулярных столкновений) Необходимая предпосылка для протекания любой реакции - столкновение между реагирующими молекулами.
Не все столкновения приводят к химическим реакциям.
К реакции приводят столкновения только между активными молекулами, запас энергии которых достаточен для взаимодействия (энергия частиц превышает энергию активации EA)
Активация молекул может быть достигнута: нагреванием, действием электро-магнитного излучения, электрического разряда, ионизирующих частиц и т.д.
Теория активных столкновений основана: 1.молекулы взаимодействуют лишь при столкновении 2.к реакции приводят столкновения молекул, у которых энергия выше энергии активации реакции 3.не сферические молекулы должны быть ориентированы при столкновении определенным образом
Для бимолекулярной реакции число активных столкновений, приводящих к реакции, можно записать как произведение общего числа столкновений на долю активных молекул
Zact = Z0 exp (-Ea/RT)
(В результате каждого столкновения расходуется две молекулы исходного вещества. Поэтому количество прореагировавших молекул в единице объема за 1 с., т.е. скорость реакции, будет равно удвоенному количеству активных столкновений за то же время и в том же объем).
С учетом необходимости определенной ориентации молекул друг относительно друга вводится стерический фактор Р
V = Р∙2Z0 exp (-Ea/RT)
Р < 1 (константа, характерная для данной реакции) Для реакций органических соединений 39)
|





 и
и  )
)






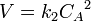







 ) называется общим порядком реакции. Реакции, для которых (n + m) = 1, 2 и т.д., называются реакциями 1-го, 2-го и т.д. порядков. Например,
) называется общим порядком реакции. Реакции, для которых (n + m) = 1, 2 и т.д., называются реакциями 1-го, 2-го и т.д. порядков. Например,
 период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
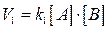 , где k1 - константа скорости прямой реакции;
, где k1 - константа скорости прямой реакции; и
и  - молярные концентрации веществ A и B.
- молярные концентрации веществ A и B. ,
, и
и  - молярные концентрации веществ D и C.
- молярные концентрации веществ D и C. уменьшается
уменьшается постепенно возрастает
постепенно возрастает




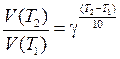 где
где  - температурный коэффициент скорости (
- температурный коэффициент скорости ( = 2
= 2  4)
4) где R - универсальная газовая постоянная;
где R - универсальная газовая постоянная;
 0.
0.
 )
)