Загальна характеристика елементів VIII В групи
Гідроксид феруму (ІІІ) – слабка основа. Але в зв’язку з тим, що аніонні комплекси Fe(III) стійкіші і легше утворюються, ніж аналогічні комплекси Fe(II), свіжоприготований Fe(OH)3 розчиняється у концентрованих лугах, виявляючи тим самим амфотерні властивості:
При сплавленні Fe2O3 або Fe(OH)3 з лугами чи карбонатами лужних металів утворюються ферити:
Дією води ферити повністю гідролізуються:
Солі феруму (ІІІ). У водному розчині солі феруму (ІІІ) утворюють гексааквакомплекс Солі феруму (ІІІ) гідролізовані сильніше, ніж солі феруму (ІІ). По-перше, це пов’язано з тим, що гідроксид феруму (ІІІ), якому відповідає сіль, є більш слабкою основою, ніж Fe(OH)2, а значить його сіль сильніше гідролізується, по-друге, катіон Fe3+ сильніше поляризує молекули води, що його оточують, ніж катіон Fe2+. Внаслідок гідролізу водні розчини солей Fe(III) мають сильно кислу реакцію. Механізм гідролізу солей феруму (ІІІ) – дуже складний. Тільки у сильно кислих розчинах (pH < 1) гідроліз солей феруму (ІІІ) пригнічується. Додаванням лугу чи тривалим кип’ятінням водних розчинів гідроліз можна довести до кінця. Внаслідок полімеризації продуктів гідролізу утворюються багатоядерні комплекси, які виділяються з розчинів у вигляді червоно-коричневої колоїдної маси, якій відповідає формула Fe2O3·х Н2О. Катіони Fe2+ та Fe3+ це активні комплексоутворювачі. Координаційні числа Fe (ІІ) та Fe (ІІІ) дорівнюють 6, рідше – 4. У якості лігандів виступають: органічні сполуки (наприклад білки), CN-, SCN-, NH3, H2O, CO. Хімічні властивості сполук феруму (VI). На відміну від кобальту та нікелю, для феруму відомі сполуки зі ступенем окиснення +6. Це головним чином солі гіпотетичної залізної кислоти H2FeO4 – ферати складу
або внаслідок сплавлення твердих реагентів:
Ферати – це червоно-фіолетові кристалічні речовини. Вони мають сильні окиснювальні властивості, які перевершують такий сильний окисник, як перманганат калію:
Важливі сполуки кобальту та нікелю. Для кобальту та нікелю найбільш характерний ступінь окиснення +2. Головними представниками цього ряду сполук є: оксиди CoO і NiO, відповідні їм гідроксиди Co(OH)2 і Ni(OH)2 та солі типу CoCl2, Co(NO3)2, CoSO4, NiCl2, NiSO4. Оксиди кобальту (ІІ) CoO (сіро-зелені кристали) та нікелю (ІІ) NiO (зелені кристали) одержують взаємодією простих речовин або термічним розкладом гідроксидів Co(OH)2 і Ni(OH)2, наприклад:
У зв’язку з тим, що оксиди кобальту (ІІ) і нікелю (ІІ) малорозчинні у воді, відповідні їм гідроксиди утворюються дією лугів на розчини їх солей:
Похідні кобальту (ІІІ) та нікелю (ІІІ) одержують із сполук Co (ІІ) і Ni (ІІ). Так, гідроксид кобальту (ІІІ) утворюється при окисненні Co(OH)2 пероксидом гідрогену:
Гідроксид нікелю (ІІ) можна окиснити лише такими сильними окисниками, як Br2 чи KBrO:
Гідроксиди Co(OH)3 та Ni(OH)3 мають сильні окиснювальні властивості.
|

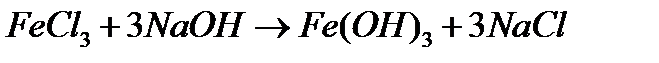


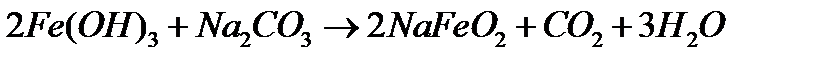

 червоно-бурого кольору. Інтенсивність забарвлення змінюється в залежності від ступеня гідролізу.
червоно-бурого кольору. Інтенсивність забарвлення змінюється в залежності від ступеня гідролізу. . Існує декілька способів їх одержання. Оскільки іон
. Існує декілька способів їх одержання. Оскільки іон 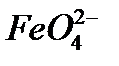 досить стійкий тільки у лужних розчинах, а в нейтральному чи кислому середовищі розкладається, одержання ферату натрію або калію відбувається у лужному середовищі окисненням сполук феруму (ІІІ) хлором чи бромом:
досить стійкий тільки у лужних розчинах, а в нейтральному чи кислому середовищі розкладається, одержання ферату натрію або калію відбувається у лужному середовищі окисненням сполук феруму (ІІІ) хлором чи бромом: ,
, .
. .
.







