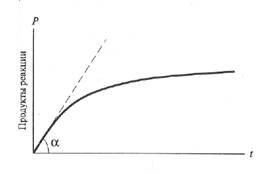
Ферментативная кинетикаФерментативный катализ существенно отличается от неферментативного, он изучает зависимость скорости реакций, катализируемых ферментами, от концентрации реагирующих веществ (ферментов и субстратов) и от условий их взаимодействия (температуры, рН, концентрации коферментов и кофакторов, наличия различных эффекторов: активаторов и ингибиторов). Наличие фермента в растворе или экстракте можно определить исходя из скорости катализируемой им реакции, о которой можно судить либо по накоплению продуктов реакции, либо по убыли субстрата. Среди химических процессов, катализируемых ферментами, основное значение имеют три типа реакций: реакции нулевого порядка, реакции первого порядка и реакции второго порядка. При реакции первого порядка скорость реакции постоянна. Если обозначить через Х концентрацию продукта, образующегося в результате реакции, а через t – время, то можно написать следующее уравнение: k0=dX/dt (слайд 2). k0 называют также начальной скоростью ферментативной реакции и обозначают как V0. На практике V0 определяют графическим методом, для чего строят кривую хода ферментативной реакции во времени. Начальная скорость определяется как тангенс угла наклона касательной, проведенной из начала координат к кривой хода ферментативной реакции (слайд 1). V0=tgα; (При работе с конкретным ферментом длительность реакции следует выбирать исходя из экспериментальных данных, по начальной скорости реакции). Этим уравнением выражается константа скорости реакции нулевого порядка. количество образующегося продукта обычно выражают в микромолях за минуту. Следовательно, если k0 (константа скорости реакции нулевого порядка) равна 2, то это значит, что за 1 минуту образуются 2 микромоля (мкмоль, µмоля) данного продукта. Ферментативные реакции первого порядка характеризуются тем, что скорость реакции в каждый момент времени пропорциональна имеющейся в наличии концентрации субстрата, т.е. dX/dt=k·(А-Х), где А - начальная концентрация субстрата, Х – концентрация превращенной части субстрата (продукта). Таким образом, (А-Х) – это концентрация исходного вещества в каждый данный момент по мере протекания реакции (слайд 3). Кривая показывает, что в первый промежуток времени, когда глубина превращения мала, реакция является реакцией нулевого порядка, а затем скорость реакции начинает снижаться, и в конце концов кинетическая кривая приближается к линии, параллельной оси абцисс. При определении кинетических данных, касающихся того или иного фермента, очень важно получить эти данные в первый момент протекания реакции, когда сохраняется прямо пропорциональная зависимость между нарастанием продукта и временем инкубации, т.е. реакция является реакцией нулевого порядка. Ферментативные реакции второго порядка характеризуются тем, что их скорость пропорциональна произведению концентрации реагирующих веществ (А+В=С+ D): V=k·[А]·[В]. К числу реакций второго порядка относятся все реакции переноса групп, например переаминирование, а также окислительно-восстановительные реакции. Примером реакции второго порядка является реакция гидролиза сахарозы под действием фермента β-фруктрофуранозидазы: С12Н22О11 + Н2О=С6Н12О6 + С6Н12О6 Сахароза глюкоза фруктоза
Хотя эта реакция является реакцией второго порядка, фактически она протекает в соответствии с законом реакции первого порядка, поскольку концентрация воды настолько велика, что практически представляет собой постоянную величину, не изменяющуюся за время протекания реакции. К числу подобных реакций, фактически протекающих по закону реакций первого порядка, относятся реакции гидролиза и гидратации. В большинстве своем ферментативные реакции являются реакциями смешанного порядка. Типичная кривая хода ферментативной реакции (слайд 1) имеет следующий вид:
Время Рис. 1. Кривая хода ферментативной реакции во времени
Ход ферментативной реакции во времени не может быть описан одним математическим уравнением, поскольку вес ферментативные реакции в самом начале своего протекания (когда имеется избыток субстрата и образовалось мало продуктов реакции) являются реакциями нулевого порядка, и только потом они приобретают характер реакции первого или второго порядка. Скорость реакции нулевого порядка со временем не меняется, зависимость количества образовавшегося продукта от времени остается прямо пропорциональной (слайд 2). Для реакций первого порядка скорость реакции в каждый данный момент времени пропорциональна имеющейся в наличии концентрации субстрата, а следовательно, наблюдается постоянное падение скорости реакции с течением времени (слайд 3).
Рис. 2. Графическое изображение реакции нулевого порядка
Рис. 3. Графическое изображение реакции первого порядка Для того чтобы правильно определить потенциальные возможности данного фермента как катализатора, нужно учитывать скорость ферментативной реакции в тот момент времени, когда факторы, замедляющие скорость ферментативной реакции (нехватка субстрата, специфическое ингибирование продуктами реакции, частичная тепловая денатурация фермента и др.), не успевают проявить свое действие и наблюдается прямая пропорциональная зависимость между продуктами реакции и временем. Все ферментативные реакции в самом начале своего протекания (т.е. когда присутствует значительный избыток субстрата и образовалось мало продуктов реакции) являются реакциями нулевого порядка, и только потом они приобретают характер реакций первого или второго порядка. Именно поэтому для определения удельной активности того или иного ферментного препарата используют данные, полученные в начальный период реакции – за первые несколько секунд или минут.
|