Слабые электролиты1) Почти все органические кислоты: СН3СООН, Н2С2О4 и др. 2) Некоторые неорганические кислоты: Н2СО3, H2S, HCN, H2SiO3, HNO2, H2SO3, H3PO4 и др. 3) Гидроксиды металлов основного характера (кроме щелочных и щелочноземельных) и гидроксид аммония NH4OH. 4) Амфотерные гидроксиды: Al(OH)3, Zn(OH)2, Cr(OH)3, Sn(OH)2, Pb(OH)2 и др. Для слабых электролитов диссоциация – обратимый процесс, для которого справедливы общие законы равновесия. Диссоциацию слабых электролитов характеризует константа равновесия, называемая константой диссоциации (ионизации) – Кд: СН3СООН ↔ СН3СОО– + Н+
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато, и каждую ступень равновесного состояния характеризует своя константа диссоциации (причем Кд1 всегда больше Кд2 и т.д), например, при диссоциации H2S: 1-я ступень H2S ↔ Н+ + HS–, Кд1 = 2-я ступень HS– ↔ Н+ + S2–, Кд2 = где [ ] – равновесные концентрации ионов и молекул. Диссоциация Cu(OH)2: 1-я ступень Cu(OH)2 ↔ Cu(ОН)+ + ОН– 2-я ступень Cu(ОН)+ ↔ Cu2+ + ОН– Амфотерные гидроксиды, например Pb(OH)2, диссоциируют по основному типу: Pb(OH)2↔ PbOH+ + OH– PbOH+ ↔ Pb2+ + OH– и кислотному: H2PbO2 ↔ H+ +
В растворах электролитов реакции протекают между ионами. Для записи ионных реакций применяют ионные уравнения. При составлении ионных уравнений реакции все слабые электролиты, газы и труднорастворимые электролиты записывают в молекулярной форме, все сильные электролиты (кроме труднорастворимых солей) в ионной форме. Примеры составления ионных уравнений реакций: - образование труднорастворимых соединений: Pb(NO3)2 + 2KI = PbI2↓ + 2KNO3 Pb2+ + 2I- = PbI2 ↓ - реакции с участием слабодиссоциирующих соединений: CH3COONa + HCl = CH3COOH + NaCl CH3COO- + H+ = CH3COOH
HCl + NaOH = NaCl + H2O H+ + OH- = H2O
HCl + NH4OH = NH4Cl + H2O H+ + NH4OH =
CH3COOH + NH4OH = CH3COONH4 + H2O CH3COOH + NH4OH = CH3COO- + - образование газообразных веществ: Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
Пример 1. Осуществить превращения NaOH → NaHSO3 → Na2SO3. Решение. NaOH + H2SO3 = NaHSO3 + H2O OH- + H2SO3 = NaHSO3 + NaOH = Na2SO3 + H2O
Пример 2. Осуществить превращения Ni(OH)2 → (NiOH)2SO4 → NiSO4 Решение. 2Ni(OH)2 + H2SO4 = (NiOH)2SO4 + H2O 2Ni(OH)2 + 2H+ +
(NiOH)2SO4 + H2SO4 = 2NiSO4 + 2H2O (NiOH)2SO4 +2H+ = 2Ni2+ + 2 Пример 3. По ионным уравнениям реакций составить молекулярные. Ca2+ + CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl Ca(OH)2 + K2CO3 = CaCO3↓ + 2KOH
Cu2+ + OH – = Cu(OH)2↓ CuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4 CuCl2 + 2KOH = Cu(OH)2 ↓ + 2KCl
Cu2+ + S2 – = CuS↓ CuCl2 + K2S = CuS↓ + 2KCl Cu(NO3)2 + Na2S = CuS↓ + 2NaNO3
|

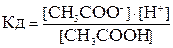 .
. =6·10-8;
=6·10-8;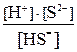 =1·10-14;
=1·10-14;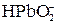
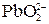
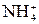 + H2O
+ H2O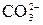 + 2H+ = CO2↑ + H2O
+ 2H+ = CO2↑ + H2O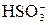 + H2O
+ H2O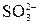 + H2O
+ H2O = (NiOH)2SO4 + H2O
= (NiOH)2SO4 + H2O


