Взаимодействие озона с органическими веществами биогенной и антропогенной природы, механизм и кинетика озонолиза.С термодинамической точки зрения все органические соединения должны окисляться не только озоном, но и молекулярным кислородом, пероксидом водорода, другими активными формами кислорода. Скорости этих процессов могут изменяться в широких пределах. Например, окисление озоном водного раствора мета-крезола протекает за тысячные доли секунды:
3СН3—С6Н4ОН + 17О3 = 21СО2 + 12Н2О
Водный раствор лигносульфоната натрия разрушается озоном за десять минут, для полного окисления тиофенола требуется не менее одного часа. В работе приведены данные по скорости озонолиза широкого спектра органических соединений, причем величина константы скорости озонолиза различных веществ варьируется в диапазоне до десятка порядков. Однако, трудноокисляемые озоном органические вещества в составе РОВ представляют собой пренебрежимо малые примеси, в основном, антропогенного происхождения, поэтому взаимодействие с озоном сложных по составу водных растворов органических веществ биогенного происхождения идет достаточно быстро: свыше 90% органического вещества окисляется за первые три минуты. Отметим, что эта общая закономерность, распространяемая и на органическое вещество почв и донных отложений. В общем виде реакцию вещества Е с различными формами активного кислорода Охможно записать следующим образом:
Общая скорость такой реакции определяется величинами констант скоростей k реакций окисления вещества Е индивидуальными формами активного кислорода Ох:
— d[E] / dt = (k1 [ Ох1 ] + k2 [ Ох2 ] + … + kn [ Охn ]) · [ E ]
Реальные условия озонолиза предусматривают непрерывную подачу озона в реактор, то есть, озон находится в избытке, а это означает, что его концентрация за время реакции изменяется пренебрежимо мало, пренебрежимо мал вклад и остальных активных форм кислорода. В этом случае реакция озонолиза может быть рассмотрена как реакция псевдопервого порядка по реагенту Е,а ее уравнениеможно записать в виде:
— d[E] / dt = kЕ · [E], где kЕ — константа скорости окисления озоном вещества Е. Графически эта зависимость представляет собой убывающую экспоненциальную кривую, причем тангенс угла наклона касательных к каждой точке кривой есть скорость реакции в этой точке. Константа скорости реакции псевдопервого порядка имеет размерность [с-1] и может быть определена из величины периода полупревращения Т ½ вещества Е:
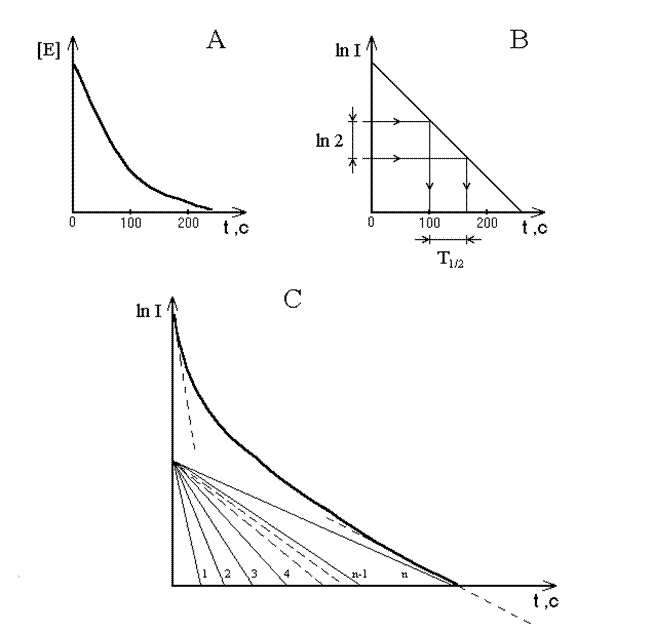
kЕ = ln2/ Т ½ ~ 0,693/ Т ½ , при этом очевидно, что kЕ независит от концентрации вещества Е и является мерой устойчивости вещества Е к озону. Метод определения Т ½ по форме кинетической кривой озонолиза вещества Е иллюстрируется на рисунке 2, где а — типичная кривая озонолиза органического вещества биогенной природы. В общем случае, при определении констант скоростей параметр «концентрация вещества Е» может быть заменен любыми измеряемыми параметрами, пропорциональными концентрации (оптическая плотность, электропроводность, люминесценция и т.п.). На рисунке 2 в приведена та же кинетическая кривая, что и на рисунке 2а, но построенная в координатах ln I - t, где I — интенсивность люминесценции, измеряемой в ходе реакции озонолиза вещества Е. Зависимость выражается прямой линией, так что, отложив в любой области оси у величину ln 2 можно получить соответствующую величину Т ½ как интервала времени, в течение которого количество вещества Е уменьшится вдвое. В случае озонолиза природных вод картина будет сложнее. В природных водах идет одновременно большое число реакций озонолиза различных веществ с различными скоростями взаимодействия с озоном. Каждая кинетическая кривая индивидуальной реакции в полулогарифмическом масштабе может быть представлена прямой (как на рисунке 2а), но их суперпозиция представляет собой суммарную кривую, изображенную на рисунке 2с. Касательные, проведенные к началу и концу этой кривой позволяют легко определить константы скоростей реакции озонолиза наиболее легкоокисляемых и наиболее трудноокисляемых компонентов сложной смеси подвергаемых озонолизу веществ.
Рисунок 2. Кинетическая характеристика озонолиза органических соединений. а — типичная кривая изменения во времени концентрации вещества Е; в — зависимость интенсивности хемилюминесценции I от времени в полулогарифмическом масштабе при окислении озоном вещества Е и определение времени полупревращения Т ½ ; с — зависимость интенсивности хемилюминесценции I от времени в полулогарифмическом масштабе при окислении озоном сложной смеси веществ Е1, Е2… Еn К началу и концу результирующей суммарный процесс кривой проведены касательные, по которым можно определить Т ½ как в случае «в»; В данном исследовании константу скорости наиболее легкоокисляемого вещества измеряли с помощью касательной, проведенной к начальным точкам кривых, построенных в полулогарифмическом масштабе. Эту константу скорости наиболее легкоокисляемого вещества обозначим kл и считаем ее мерой неустойчивости вещества к окислению, то есть, мерой биодоступности, снижающейся при антропогенной нагрузке, в частности, при химическом загрязнении водных экосистем [6].
|

 Е + Ох продукты
Е + Ох продукты