Химические Свойства соляной кислоты1. Диссоциация: HCl 2. Взаимодействие с металлами: а) реагирует с металлами, стоящими в электрохимическом ряду напряжений металлов до водорода: HCl + Mg = MgCl2 + H2; HCl + Fe = FeCl2 + H2; б) в присутствии кислорода (или H2O2) реагирует с металлами (кроме Ag, Pt, Au): HCl + Cu + O2 = CuCl2 + H2O; HCl + Fe + O2 = FeCl3 + H2O. 3. Взаимодействие с оксидами металлов: а) реакции обмена: HCl + (FeFe2)O4 = FeCl2 + FeCl3 + H2O; HCl + Fe2O3 = FeCl3 + H2O; HCl + Al2O3 = AlCl3 + H2O; б) вступает в окислительно-восстановительные реакции с оксидами-окислителями (MnO2, PbO2, CrO3, Mn2O7, Co2O3, Ni2O3, Co3O4 и др.) с выделением Cl2: HCl + Co2O3 = CoCl2 + Cl2 + H2O; HCl + (MnMn2)O4 + HCl = MnCl2 + Cl2 + H2O; HCl + MnO2 = MnCl2 + Cl2 + H2O; HCl + CrO3 = CrCl3 + Cl2 + H2O. в) в присутствии кислорода (или Н2О2) реагирует с некоторыми оксидами металлов (FeO, Cu2O, CrO, Fe3O4): HCl + FeO + O2 = FeCl3 + H2O; HCl + FeO + H2O2 = FeCl3 + H2O; HCl + (FeFe2)O4 + H2O2 = FeCl3 + H2O. 4. Взаимодействие с основными и амфотерными гидроксидами: а) реакции обмена HCl + NaOH = NaCl + H2O; HCl + Zn(OH)2 = ZnCl2 + H2O; HCl + Fe(OH)2 = FeCl2 + H2O; HCl + Ca(OH)2 = CaOHCl + H2O; б) в присутствии кислорода (или Н2О2) реагирует с гидроксидами некоторых металлов: HCl + Fe(OH)2 + O2 = FeCl3 + H2O; HCl + Fe(OH)2 + H2O2 = FeCl3 + H2O; в) с комплексными основаниями HCl + [Ag(NH3)2]OH = AgCl¯ + NH4Cl + H2O; 5. Взаимодействие с аммиаком: HCl + NH3 = NH4Cl (хлорид аммония, или нашатырь). 6. Взаимодействие с солями: а) вступает в реакции обмена с кислыми, средними, основными солями, разрушает комплексные соли: HCl + CaCO3 = CaCl2 + CO2 + H2O; HCl(разб) + Na2SO3S = NaCl + SO2 + S¯ + H2O; HCl + AgNO3 = AgCl¯ + HNO3; HCl + NaHCO3 = NaCl + CO2 + H2O; HCl + Na2SiO3 = NaCl + H2SiO3¯; HCl + (CuOH)2CO3 = CuCl2 + CO2 + H2O; HCl + K2[Zn(OH)4] = KCl + ZnCl2 + H2O; HCl + K2[Zn(OH)4] = KCl + Zn(OH)2¯ + H2O; HCl + [Ag(NH3)2]Cl = AgCl¯ + NH4Cl + H2O; HCl + Co2(PO4)3 = CoCl2 + H3PO4 HCl + Ca2(PO4)3 = CaCl2 + H3PO4 б) концентрированная с окислителями (KMnO4, K2Cr2O7, KClO3, KClO4, K2FeO4, NaClO, NaClO2, NaBiO3) вступает в окислительно-восстановительные реакции: HCl + KMnO4 = MnCl2 + Cl2 + KCl + H2O; HCl + K2Cr2O7 = CrCl3 + Cl2 + KCl + H2O; HCl + KClO3 = Cl2 + KCl + H2O. в) в присутствии окислителей реагирует с некоторыми солями (FeCl2, CrCl2, CuCl, SnCl2): HCl + FeCl2 + O2 = FeCl3 + H2O; HCl + FeCl2 + H2O2 = FeCl3 + H2O; HCl + SnCl2 + Cl2 = H2[SnCl6]. 7. Окислительные свойства смеси концентрированных соляной и азотной кислот: HCl + HNO3 = (NO)Cl + Cl(атомарный) + H2O; HCl + HNO3 HCl + HNO3 + Fe = Fe(NO3)3 + NO + H2O; HCl + HNO3 + Cu = CuCl2 + NO + H2O; HCl + HNO3 + Au = H[AuCl4] + NO + H2O; HCl + HNO3 + Sn = H2[SnCl6] + NO + H2O; HCl + HNO3 + Pt = H2[PtCl6] + NO + H2O; HCl + HNO3 + FeO = FeCl3 + NO + H2O; HCl + HNO3 + (FeFe2)O4 = FeCl3 + NO + H2O; HCl + HNO3 + Fe(OH)2 = FeCl3 + NO + H2O; HCl + HNO3 + Hg = HgCl2 + NO + H2O; HCl + HNO3 + FeCl2 = FeCl3 + NO + H2O; HCl + HNO3 + CuCl = CuCl2 + NO + H2O; HCl + HNO3 + As = AsCl3 + NO + H2O; HCl + HNO3 + Sb = H[SbCl6] + NO + H2O; 8. Взаимодействие с гидридами металлов, гидридокомплексными соединениями: HCl + NaH = NaCl + H2; HCl + CaH2 = CaCl2 + H2; HCl + Na[BH4] + H2O = B(OH)3¯ + H2 + NaCI HCl + Na[AlH4] + H2O = AlCl3 + H2 + NaCI. 9. Взаимодействие с карбонилами металлов: HCl + [Fe(CO)5] = FeCl2 + CO + H2; HCl + [Mn2(CO)10] = MnCl2 + CO + H2. 10. Взаимодействие с сульфидами металлов: HCl + Na2S = NaCl + H2S; HCl + Al2S3 = AlCl3 + H2S; HCl + FeS = FeCl2 + H2S; HCl(конц) + ZnS = ZnCl2 + H2S; HCl(конц) + SnS = H[SnCl3] + H2S; HCl(конц) + SnS2 = H[SnCl3] + H2S + S¯; HCl(конц, гор) + Sb2S3 = H3[SbCl6] + H2S. Сульфиды многих металлов (Hg, Ag, Bi, Cu, Pb и др.) нерастворимы в разбавленной соляной кислоте.
|

 H+ + Cl –; HCl + H2O
H+ + Cl –; HCl + H2O 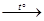 NO + Cl2 + H2O;
NO + Cl2 + H2O;


