Примеры решения задач. 1. Указать ряд правильных значений реакции среды водных растворов солей: K2SO3, ZnCl2, Cr(NO3)3, NaNO31. Указать ряд правильных значений реакции среды водных растворов солей: K2SO3, ZnCl2, Cr(NO3)3, NaNO3.
Решение: Реакция среды определяется сильным электролитом, участвующим в образовании соли. Сульфит калия (K2SO3). Соль образована слабой кислотой (H2SO3) и сильным основанием (KOH), поэтому реакция среды щелочная (рН>7). Хлорид цинка (ZnCl2). Соль образована сильной кислотой (HCl) и слабым основанием (Zn(OH)2), поэтому реакция среды кислая (pH<7). Нитрат хрома (III) (Cr(NO3)3). Соль образована сильной кислотой (HNO3) и слабым основанием (Cr(OH)3), поэтому реакция среды кислая (pH<7). Нитрат калия (КNO3). Соль образована сильным основанием (КOH) и сильной кислотой (HNO3), поэтому гидролизу эта соль не подвергается. Реакция среды – нейтральная (рН = 7). Ответ: б) > 7, < 7, < 7, 7
2. Указать ряд солей, в котором все соли в растворе подвергаются гидролизу. а) NH4NO2, Na2CO3, NaNO3; б) Na2CO3, Al2(SO4)3, NaNO3 в) NH4NO2, Na2CO3, Al2(SO4)3; г) Al2(SO4)3, NaNO3, NH4NO2 Решение: Гидролизу подвергаются соли, которые образованы при взаимодействии слабой кислоты и слабого основания; слабой кислоты и сильного основания; сильной кислоты и слабого основания. Представим все соли как продукты взаимодействия кислоты и основания. NH4NO2 – соль подвергается гидролизу NH4OH + HNO2 Слаб. Слаб.. Na2CO3 - соль подвергается гидролизу NaOH + H2CO3 Сильн. Слаб Al2(SO4)3 - соль подвергается гидролизу Al(OH)3 + H2SO4 Слаб. Сильн. NaNO3 - соль не подвергается гидролизу NaOH + HNO3 Сильн. Сильн Ответ: в): NH4NO2, Na2CO3, Al2(SO4)3.
3. Указать пару правильных молекулярных уравнений реакций соответствующих приведенным сокращенным ионно-молекулярным уравнениям: Ca+2 + CO a) CaCl2 + H2CO3 + CaCO3; 2HCN + Na2S = 2NaCl + H2S б) Ca(NO3)2 + K2CO3 = CaCO3 + 2KNO3; 2HCl + K2S = 2KCl + H2S в) CaSO4 + H2CO3 = CaCO3 + Na2SO4; H2SO4 + Na2S = Na2SO4 + H2S г) Ca(OH)2 + H2CO3 = CaCO3 + H2O; 2HNO3 + CaS = Ca(NO4)2 + H2S
Решение: При составлении молекулярного уравнения по заданному сокращенному ионному уравнению следует учесть, что каждому иону сокращенного ионно-молекулярного уравнения должен соответствовать сильный электролит в молекулярном уравнении. Поэтому, при переходе от сокращенного к полному ионному уравнению к каждому иону нужно добавить такие противоположно заряженные ионы, чтобы образовался сильный электролит (см. табл. 7.2). Для Са+2 – используем любую растворимую соль кальция (CaCl2, Ca(NO3)2 и др.) Для CO Для Н+ - используем любую сильную кислоту (HCl, HNO3 и др.) Для S-2 – используем любую растворимую соль сероводородной кислоты (K2S, Na2S и др.) Для ОН- - любая щелочь (NaOH, KOH и др.) Ответ: б) Ca(NO3)2 + K2CO3 = CaCO3 + 2KNO3; 2HCl + K2S = 2KCl + H2S
4.Написать ионно-молекулярные уравнения и молекулярные гидролиза солей: а) сульфата меди (II), б) карбоната натрия, и указать реакцию среды в их водных растворах.
5.Написать ионно-молекулярное и молекулярное уравнения гидролиза сульфата хрома (III). Как влияет на равновесие гидролиза прибавление к раствору следующих веществ: а) соляной кислоты; б) гидроксида калия; в) нитрата натрия? Решение:
а) уравнения гидролиза · · 2 ·
б) равновесие гидролиза соли может смещаться при изменении внешних условий (согласно принципу Ле Шателье);
при добавлении
2
при добавлении
2
5. Что произойдет при сливании растворов хлорида железа (II) и карбоната натрия? Написать уравнения реакций в ионно-молекулярной и молекулярной формах. Решение: · до сливания в растворе каждой соли протекает ее гидролиз по I ступени:
· после сливания гидролиз усиливается вследствие связывания ионов
|

 гидролиза
K2SO3
гидролиза
K2SO3
 = CaCO3; 2H+ + S-2 = H2S
= CaCO3; 2H+ + S-2 = H2S ↹
↹ 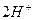 +
+  ) и слабым двухатомным основанием (
) и слабым двухатомным основанием (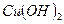 ↹
↹ 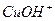 +
+  ), следовательно подвергается гидролизу по катиону с образованием малодиссоциирующего основного катиона
), следовательно подвергается гидролизу по катиону с образованием малодиссоциирующего основного катиона  + 2 H2O↹ 2
+ 2 H2O↹ 2  ↹
↹  +
+  ↹
↹  +
+  ↹
↹  +
+  ) следовательно подвергается гидролизу по аниону с образованием малодиссоциирующего аниона
) следовательно подвергается гидролизу по аниону с образованием малодиссоциирующего аниона 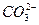 + H2O ↹; +
+ H2O ↹; +  +
+  :
: + 3
+ 3 
 ↹ 2
↹ 2  + 2
+ 2  ↹ 2
↹ 2  +
+ 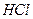 в раствор поступают ионы
в раствор поступают ионы  ); равновесие гидролиза смещается влево, гидролиз ослабевает:
); равновесие гидролиза смещается влево, гидролиз ослабевает:
 в раствор поступают ионы
в раствор поступают ионы 


 +
+  ↹
↹  +
+  и газообразного
и газообразного  :
:



 +
+ 


