Растворимость
Мы говорим: "сахар растворяется в воде хорошо" или "мел плохо растворяется в воде". Но можно и количественно оценить способность того или иного вещества к растворению или, другими словами, растворимость вещества. Растворимостью – называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе. Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошорастворимым. Если растворяется менее 1 г вещества – вещество малорастворимо. Наконец, вещество считают практически нерастворимым, если в раствор переходит менее 0,01 г вещества. Абсолютно нерастворимых веществ не бывает. Растворимость, выраженная при помощи массы вещества, которое может раствориться в 100 г воды при данной температуре, называют также коэффициентом растворимости. В качестве примера приведем растворимость (в граммах вещества на 100 г воды при комнатной температуре) нескольких веществ: твердых, жидких и газообразных, среди которых многие имеют похожие химические формулы (таблица 7-2). Таблица 7- 2. Растворимость некоторых веществ в воде при комнатной температуре, растворимость большинства (но не всех!) твердых веществ с увеличением температуры увеличивается, а растворимость газов, наоборот, уменьшается. Это связано прежде всего с тем, что молекулы газов при тепловом движении способны покидать раствор гораздо легче, чем молекулы твердых веществ. **Если измерять растворимость веществ при разных температурах, то обнаружится, что одни вещества заметно меняют свою растворимость в зависимости от температуры, другие – не очень сильно (см. табл. 7-3).
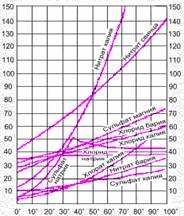
Если полученные в опытах значения нанести на оси координат, то получаются так называемые кривые растворимости различных веществ (рис. 7-3). Эти кривые имеют практическое значение. По ним легко узнать, сколько вещества (например, KNO3) выпадет в осадок при охлаждении до 20 С насыщенного раствора, приготовленного при 80 С.
Таблица 7-3. Влияние температуры на растворимость некоторых твердых веществ. В таблице приведена растворимость в г/100 г воды
Рис. 7-3. Кривые растворимости твердых (а) и газообразных (б) веществ. С помощью таких операций очищают вещества. Дело в том, что при охлаждении ненасыщенного раствора образуется насыщенный раствор, но насыщенный по основному веществу, которого больше всего, а не по примесям. Поэтому при охлаждении в осадок выпадает только чистое вещество, а примеси (вместе с частью вещества) остаются в растворе. Чистые кристаллы отфильтровывают от охлажденного, загрязненного примесями раствора. Этот способ очистки называется ПЕРЕКРИСТАЛЛИЗАЦИЕЙ. Так очищают, например, многие лекарственные препараты.
Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в справочниках в граммах на 100 г растворителя (при определённых условиях).
Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления.
Природа растворяемого вещества. Кристаллические вещества подразделяются на:
P - хорошо растворимые (более 1,0 г на 100 г воды); M - малорастворимые (0,1 г - 1,0 г на 100 г воды); Н - нерастворимые (менее 0,1 г на 100 г воды). (Смотри таблицу растворимости)
Природа растворителя. При образовании раствора связи между частицами каждого из компонентов заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества - наоборот.
Влияние температуры. Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (Например,Ca(OH)2 в воде) и наоборот. Для большинства солей характерно увеличение растворимости при нагревании. Практически все газы растворяются с выделением тепла. Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается.
Влияние давления. С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
|